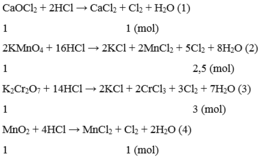Điều chế clo bằng cách cho HCl đặc, dư pư với mỗi chất KMnO4, MnO2, K2CR2O7. Nếu số mol khí clo thu được trong 3 pư có tỉ lệ tương ứng là 1:1:3 thì tỉ lệ số mol 3 chất trên lần lượt là:..?

Những câu hỏi liên quan
Cho các chất sau: PbO2, MnO2, KMnO4, K2Cr2O7, KClO3, CaOCl2. Lấy hai chất X và Y có số mol bằng nhau trong số các chất trên, đem tác dụng với dung dịch HCl đặc, dư (ở điều kiện thích hợp, phản ứng xẩy ra hoàn toàn) thì thấy thu được số mol khí clo như nhau. Hỏi có bao nhiêu cặp X và Y thỏa mãn? A. 2 B. 3 C. 4 D. 5
Đọc tiếp
Cho các chất sau: PbO2, MnO2, KMnO4, K2Cr2O7, KClO3, CaOCl2. Lấy hai chất X và Y có số mol bằng nhau trong số các chất trên, đem tác dụng với dung dịch HCl đặc, dư (ở điều kiện thích hợp, phản ứng xẩy ra hoàn toàn) thì thấy thu được số mol khí clo như nhau. Hỏi có bao nhiêu cặp X và Y thỏa mãn?
A. 2
B. 3
C. 4
D. 5
Đáp án C
Với bài toán này ta suy luận nhanh như sau:Khí Clo thoát ra như nhau khi số mol e nhận như nhau:
Với PbO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với MnO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với KMnO4 số oxi hóa Mn thay đổi 5 từ +7 xuống +2
Với K2Cr2O7 số oxi hóa Cr thay đổi 6 từ +6.2 xuống +3.2
Với KClO3 số oxi hóa Clo thay đổi 6 từ +5 xuống – 1
Với CaOCl2 số oxi hóa Clo thay đổi 2 từ +1 xuống – 1
Vậy có 4 cặp thỏa mãn là :
PbO2 với MnO2 ; PbO2 với CaOCl2 ; MnO2 với PbO2; K2Cr2O7 với KClO3
Đúng 0
Bình luận (0)
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl. a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
Đọc tiếp
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
a) Giả sử lấy lượng mỗi chất là a gam
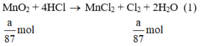
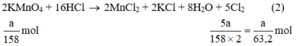
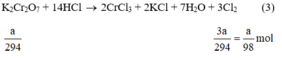
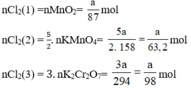
Ta có: 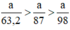
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 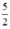 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là A. KMnO4 B. K2Cr2O7 C. CaOCl2 D. MnO2
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là
A. KMnO4
B. K2Cr2O7
C. CaOCl2
D. MnO2
Trong phản ứng với HCl đặc thì chất nào nhận electron nhiều nhất thì cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
Vậy chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Đáp án B.
Đúng 0
Bình luận (0)
47. Hoà tan hoàn toàn 57,45g hỗn hợp X gồm Kmno4 , Kclo3 , K2CR2O7 bằng dd HCl đặc , dư . Sau pư hoàn toàn thu đc dd Y chứa 29,8g muối Kcl , a mol muối Mncl2 , b mol muối CrCl3 và V lít khí Cl2(đktc). Biết a:b 1:2 , giá trị của V là?
48. Trong phòng thí nghiệm người ta điều chế khí Clo bằng cách cho HCl đặc , dư tác dụng với m1 gam MnO2 , m2 gam Kmno4 , m3 gam Kclo3 hoặc m4 gam K2CR2O7. Biết rằng thể tích khí Clo thủ đc với mỗi trường hợp đều như nhau. Tính Tỉ lệ m1:m2:m3:m4
Đọc tiếp
47. Hoà tan hoàn toàn 57,45g hỗn hợp X gồm Kmno4 , Kclo3 , K2CR2O7 bằng dd HCl đặc , dư . Sau pư hoàn toàn thu đc dd Y chứa 29,8g muối Kcl , a mol muối Mncl2 , b mol muối CrCl3 và V lít khí Cl2(đktc). Biết a:b =1:2 , giá trị của V là?
48. Trong phòng thí nghiệm người ta điều chế khí Clo bằng cách cho HCl đặc , dư tác dụng với m1 gam MnO2 , m2 gam Kmno4 , m3 gam Kclo3 hoặc m4 gam K2CR2O7. Biết rằng thể tích khí Clo thủ đc với mỗi trường hợp đều như nhau. Tính Tỉ lệ m1:m2:m3:m4
47.
Đặt \(n_{KClO_3}=c\left(mol\right)\)
\(n_{KCl}=0,2\left(mol\right)\)
\(BTNT.Cr\Rightarrow n_{K_2Cr_2O_7}=\frac{1}{2}n_{CrCl_3}=0,5b\left(mol\right)\\ BTNT.Mn\Rightarrow n_{KMnO_4}=n_{MnCl_2}=a\left(mol\right)\\ \Rightarrow m_X=158x+122,5c+147b=57,45\left(1\right)\\ BTNT.K\Rightarrow n_{KCl}=n_{KMnO_4}+n_{KClO_3}+2n_{K_2Cr_2O_7}\\ =a+b+c=0,4\left(2\right)\\ \text{Mà }2a=b\left(3\right)\)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\\c=0,1\end{matrix}\right.\)
QT nhường e:
Mn+7 + 5e ----> Mn+2
0,1_____0,5
Cl+5 + 6e ----> Cl-
0,1____0,6
Cr2+6 + 6e ----> 2Cr+3
_______0,6______0,2
QT nhận e: 2Cl- ----> Cl2 + 2e
BT e \(\Rightarrow n_{Cl_2}=0,85\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=19,04\left(l\right)\)
Bài 47:
Gọi số mol KMnO4; KClO3; K2Cr2O7 lần lượt là x, y, z.
\(\Rightarrow158x+122,5y+294z=57,45\)
Phản ứng xảy ra:
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
\(K_2Cr_2O_7+14HCl\rightarrow2KCl+2CrCl_3+3Cl_2+7H_2O\)
\(\Rightarrow n_{KCl}=n_{KMnO4}+n_{KClO3}+2n_{K2Cr2O7}=x+y+2z=\frac{29,8}{39+35,5}=0,4\left(mol\right)\)
\(n_{MnCl2}=n_{KMnO4}=x;n_{CrCl3}=n_{K2Cr2O7}=z=2x\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,0633\\y=0,0835\\z=0,1266\end{matrix}\right.\)
\(\Rightarrow n_{Cl2}=\frac{5}{2}n_{KMnO4}+3n_{KClO3}+3n_{K2Cr2O7}\)
\(=2,5x+3y+3z=0,78855\left(mol\right)\)
\(\Rightarrow V=0,78855.22,4=17,66352\left(l\right)\)
47. \(n_{KCl}=0,4\left(mol\right)\)
Đặt \(n_{KClO_3}=c\left(mol\right)\)
\(BTNT.Cr:\Rightarrow n_{K_2Cr_2O_7}=\frac{1}{2}n_{CrCl_3}=0,5b\left(mol\right)\\ BTNT.Mn:\Rightarrow n_{KMnO_4}=n_{MnCl_2}=a\left(mol\right)\)
\(BTNT.K\Rightarrow n_{KCl}=n_{KMnO_4}+2n_{K_2Cr_2O_7}+n_{KClO_3}\\ =a+b+c=0,4\left(1\right)\)
\(\text{Mặt khác }:m_X=158a+147b+122,5c=57,45\left(2\right)\\ a=2b\left(2\right)\\ \left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=\frac{169}{955}\\b=\frac{169}{1910}\\c=\frac{257}{1910}\end{matrix}\right.\)
QT nhận e: Mn+7 + 5e ----> Mn+2
Cl+5 + 6e ----> Cl-
Cr2+6 + 6e ----> 2Cr+3
QT nhường e: Cl- ----> Cl2 + 2e
\(BT\text{ }e\Rightarrow n_{Cl_2}=\frac{5n_{KMnO_4}+3n_{CrCl_3}+6_{KClO_3}}{2}=0,979\\ \Rightarrow V_{Cl_2}=21,93\left(l\right)\)
Xem thêm câu trả lời
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí
C
l
2
nhiều nhất là A.
K...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. K M n O 4
B. C a O C l 2
C. K 2 C r 2 O 7
D. M n O 2
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. C a O C l 2
B. K M n O 4
C. K 2 C r 2 O 7
D. M n O 2
Chọn đáp án C
C a O C l 2 + 2HCl → C a C l 2 + C l 2 + H 2 O
1 1 mol
2 K M n O 4 + 16HCl → 2KCl + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
1 2,5 mol
K 2 C r 2 O 7 + 14HCl → 2KCl + 2 C r C l 3 + 3 C l 2 + 7 H 2 O
1 3 mol
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
1 1 mol
Vậy nếu cho cùng 1 mol mỗi chất C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , MnO2 thì K 2 C r 2 O 7 cho lượng khí C l 2 nhiều nhất.
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là A. K2Cr2O7 B. MnO2 C. CaOCl2 D. KMnO4
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là
A. K2Cr2O7
B. MnO2
C. CaOCl2
D. KMnO4
Đáp án A
Đáp án A do Cr nhường 6e (có 2 nguyên tử Cr), nhường nhiều e nhất nên tạo ra nhiều khí nhấ
Đúng 0
Bình luận (0)
Cho các chất: KMnO4, K2Cr2O7, MnO2 có cùng số mol lần lượt phản ứng với dd HCl đặc dư. Các chất tạo ra lượng khí Cl2 (cùng điều kiện) theo chiều tăng dần từ trái qua phải là: A. MnO2; K2Cr2O7; KMnO4 B. MnO2 ; KMnO4; K2Cr2O7 C. K2Cr2O7 ; MnO2 ; KMnO4 D. KMnO4 ; MnO2 ; K2Cr2O7
Đọc tiếp
Cho các chất: KMnO4, K2Cr2O7, MnO2 có cùng số mol lần lượt phản ứng với dd HCl đặc dư. Các chất tạo ra lượng khí Cl2 (cùng điều kiện) theo chiều tăng dần từ trái qua phải là:
A. MnO2; K2Cr2O7; KMnO4
B. MnO2 ; KMnO4; K2Cr2O7
C. K2Cr2O7 ; MnO2 ; KMnO4
D. KMnO4 ; MnO2 ; K2Cr2O7
Chọn đáp án B
Ta có thể tư duy như sau : Cl2 thoát ra càng nhiều khi số oxi hóa của các nguyên tố thay đổi càng lớn.Nhận thấy : MnO2 thay đổi 2 từ +4 xuống +2
KMnO4 thay đổi 5 từ +7 xuống +2
K2Cr2O7 thay đổi 6 từ +6.2 xuống +3.2
Đúng 0
Bình luận (0)
Cho các chất: KMnO4, K2Cr2O7, MnO2 có cùng số mol lần lượt phản ứng với dd HCl đặc dư. Các chất tạo ra lượng khí Cl2 (cùng điều kiện) theo chiều tăng dần từ trái qua phải là: A. MnO2; K2Cr2O7; KMnO4. B. MnO2; KMnO4; K2Cr2O7. C. K2Cr2O7; MnO2; KMnO4. D. KMnO4; MnO2; K2Cr2O7.
Đọc tiếp
Cho các chất: KMnO4, K2Cr2O7, MnO2 có cùng số mol lần lượt phản ứng với dd HCl đặc dư. Các chất tạo ra lượng khí Cl2 (cùng điều kiện) theo chiều tăng dần từ trái qua phải là:
A. MnO2; K2Cr2O7; KMnO4.
B. MnO2; KMnO4; K2Cr2O7.
C. K2Cr2O7; MnO2; KMnO4.
D. KMnO4; MnO2; K2Cr2O7.
Chọn đáp án B
Ta có thể tư duy như sau: Cl2 thoát ra càng nhiều khi số oxi hoá của các nguyên tố thay đổi càng lớn. Nhận thấy: MnO2 thay đổi 2 từ +4 suống +2
KMnO4 thay đổi 5 từ +7 xuống +2
K2Cr2O7 thay đổi 6 từ +6.2 xuống +3.2
Đúng 0
Bình luận (0)