Khối lượng Fe trong 18g Fe2O3

Những câu hỏi liên quan
Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 đến Fe thì cần đủ 2,24 lít CO (đktc). Khối lượng sắt thu được là
A. 15g B. 16g
C. 17g D. 18g
\(n_{CO}=0,1mol\)
Bảo toàn C : \(n_{CO_2}=n_{CO}=0,1mol\)
Bảo toàn khối lượng : \(m_{oxit}+m_{CO}=m_{CO_2}+m_{Fe}\)
=> \(m_{Fe}=17,6+0,1.28-0,1.44=16g\)
Đáp án B
Đúng 1
Bình luận (0)
\(n_{CO}=\dfrac{2,24}{22,4}=0,1mol\)
BT C: \(n_{CO_2}=n_{CO}=0,1mol\)
BTKL: \(m_{hh}+m_{CO}=m_{Fe}+m_{CO_2}\)
\(\Rightarrow17,6+0,1\cdot28=m_{Fe}+0,1\cdot44\)
\(\Rightarrow m_{Fe}=16\left(g\right)\)
Chọn B
Đúng 0
Bình luận (0)
Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 đến Fe thì cần đủ 2,24 lít CO (đktc). Khối lượng sắt thu được là :
A. 15g
B. 16g
C. 17g
D. 18g
nCO = 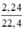 = 0,1 mol
= 0,1 mol
BT nguyên tố C ⇒ nCO2 = nCO = 0,1 mol
BT khối lượng: mhỗn hợp + mCO = mFe + mCO2
⇒ mFe = 17,6 + 0,1. 28 – 0,1. 44 = 16g
Đáp án B
Đúng 0
Bình luận (0)
Câu 6: Trong 0,5 mol sắt có khối lượng là: A. 15g B. 18g C. 24g D. 40gCâu 7: Số mol của 24g Fe2O3 là: A. 0,15 mol B. 0,2 mol C. 0,1 mol D. 0,25 molCâu 8: Số mol của 8,96 lít khí CO2 là: A. 0,1 mol B. 0,3 mol C. 0,4 mol D. 0,5 molCâu 9: 1,5 mol khí Oxi (O2) chiếm thể tích bao nhiêu lít ở đktc? A. 8,96 l...
Đọc tiếp
Câu 6: Trong 0,5 mol sắt có khối lượng là:
A. 15g B. 18g C. 24g D. 40g
Câu 7: Số mol của 24g Fe2O3 là:
A. 0,15 mol B. 0,2 mol C. 0,1 mol D. 0,25 mol
Câu 8: Số mol của 8,96 lít khí CO2 là:
A. 0,1 mol B. 0,3 mol C. 0,4 mol D. 0,5 mol
Câu 9: 1,5 mol khí Oxi (O2) chiếm thể tích bao nhiêu lít ở đktc?
A. 8,96 lít B. 3,36 lít C. 8,4 lít D. 7,62 lít
Câu 6: Trong 0,5 mol sắt có khối lượng là:
A. 15g B. 18g C. 24g D. 40g
\(m_{Fe}=n\cdot M=0,5\cdot56=28\left(g\right)\)
xem lại đề
Câu 7: Số mol của 24g Fe2O3 là:
A. 0,15 mol B. 0,2 mol C. 0,1 mol D. 0,25 mol
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{24}{56\cdot2+16\cdot3}=0,15\left(mol\right)\)
Câu 8: Số mol của 8,96 lít khí CO2 là:
A. 0,1 mol B. 0,3 mol C. 0,4 mol D. 0,5 mol
\(n_{CO_2}=\dfrac{V}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Câu 9: 1,5 mol khí Oxi (O2) chiếm thể tích bao nhiêu lít ở đktc?
A. 8,96 lít B. 3,36 lít C. 8,4 lít D. 7,62 lít
\(V_{O_2}=n\cdot22,4=1,5\cdot22,4=33,6\left(l\right)\) xem lại đề
Đúng 2
Bình luận (3)
Người ta sản suất gang bằng cách dùng CO khử Fe2O3 theo phản ứng :Fe2O3 + CO→Fe+CO2
Biết trong gang chứa 98% khối lượng là Fe. Tính khối lượng Fe2O3 và thể tích CO cần dùng để sản xuất được 1 tấn gang nói trên
PTHH: \(Fe_2O_3+3CO\xrightarrow[]{t^o}2Fe+3CO_2\uparrow\)
Đổi 1 tấn = 1000 kg
Ta có: \(n_{Fe}=\dfrac{1000\cdot98\%}{56}=17,5\left(kmol\right)\)
\(\Rightarrow n_{CO}=26,25\left(kmol\right)\) \(\Rightarrow V_{CO}=26,25\cdot22,4=588\left(m^3\right)\)
Đúng 2
Bình luận (0)
khử hoàn toàn 34,8 g hỗn hợp X gồm Fe và Fe2O3 thu được 25,2 g Fe .khối lượng của Fe2O3 có trong hỗn hợp x là
\(n_{Fe}=\dfrac{25,2}{56}=0,45mol\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_{Fe_2O_3}=y\end{matrix}\right.\)
\(FeO+H_2\rightarrow\left(t^o\right)Fe+H_2O\)
x x ( mol )
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
y 2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}72x+160y=34,8\\x+2y=0,45\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Fe_2O_3}=0,15.160=24g\)
Đúng 2
Bình luận (0)
Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là A. 1,68; 1,44; 1,6 B. 1,6; 1,54; 1,64 C. 1,6; 1,44; 1,64 D. 1,68; 1,6; 1,44
Đọc tiếp
Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là
A. 1,68; 1,44; 1,6
B. 1,6; 1,54; 1,64
C. 1,6; 1,44; 1,64
D. 1,68; 1,6; 1,44
Đáp án D
Các phản ứng xảy ra:
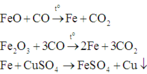
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
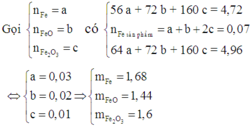
Đúng 0
Bình luận (0)
Tính % khối lượng của Fe trong CTHH Fe2O3 là
%mFe = \(\frac{56.2}{56.2+16.3}\).100% = 70%
Hãy tính khối lượng Fe có trong:
a) 30g sắt pirit Fe2O3?
b) 40g sắt (III) oxit Fe2O3?
PTK của Fe2O3=160g/mol
=> %Fe=\(\frac{56.2}{160}.100=70\%\)
=> khối lượng Fe có trong 30g Fe2O3 là \(\frac{30}{100}.70=21\)g
b) theo câu a % Fe=70%
=> khối lượng của Fe trpng 40g Fe2O3 là:
\(\frac{40}{100}.70=28g\)
Đúng 0
Bình luận (1)
a) nFe2O3 = 30 : 60 = 0,1875 mol
Trong 1 mol Fe2O3 có 2 mol Fe , 3 mol O
<=> Trong 0,1875 mol Fe2O3 có x mol Fe , y mol O
Suy ra : x = nFe = 0,1875 x 2 : 1 = 0,375 ( mol )
=> mFe = 0,375 x 56 = 21 g
b) Tương tự nhé :))
nFe2O3 = 40 : 160 = 0,25 mol
Trong 1 mol Fe2O3 có 2 mol Fe , 3 mol O
<=> Trong 0,25 mol Fe2O3 có x mol Fe , y mol O
Suy ra : x = nFe = 0,25 x 2 : 1 = 0,5( mol )
=> mFe = 0,5 x 56 = 28 g
Đúng 0
Bình luận (0)
không biết bạn viết đề như thế nào nhưng hình như quặng pirit sắt là FeS2 cơ mà ?
Đúng 0
Bình luận (2)
tính khối lượng của Fe trong 50kg quặng chứa 80%Fe2O3
Đầu tiên ta tính m Fe2O3 = 50 . (80/100) = 40kg
%m Fe = \(\frac{56.2.100\%}{56.2+16.3}\) = 70 %
==> m Fe = \(\frac{40.70\%}{100\%}\) = 28 kg
đúng tick mik nhé ^^
----------------------------------------------------------------Nam
Đúng 1
Bình luận (1)
Khối lượng của Fe2O3 trong quặng:
\(m_{Fe_2O_3}=\frac{80.50}{100}=40\left(kg\right)\)
\(\%m_{Fe}=\frac{n_{Fe}.M_{Fe}}{M_{Fe_2O_3}}.100\%=\frac{2.56}{160}.100=70\%\)
=>Khối lượng của Fe:
\(m_{Fe}=\frac{m_{Fe_2O_3}.\%m_{Fe}}{100\%}=\frac{40.70}{100}=28\left(kg\right)\)
Đúng 0
Bình luận (0)




























