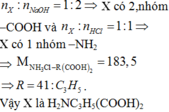Cho 13,92 gam FexOy tan vừa đủ trong 600ml dung dịch hcl 0,8M. Tìm CT oxit

Những câu hỏi liên quan
Cho 5,1 g 1 oxit của kim loại R (III) tan vừa đủ trong 150ml dung dịch H2SO4 1M
a) viết PTHH
b) tìm CTHH của oxit
a) Gọi CTHH của oxit là $R_2O_3$
$R_2O_3 + 3H_2SO_4 \to R_2(SO_4)_3 + 3H_2$
b) $n_{H_2SO_4} = 0,15.1 = 0,15(mol)$
$n_{oxit} =\dfrac{1}{3}n_{H_2SO_4} = 0,05(mol)$
$M_{oxit} = 2R + 16.3 = \dfrac{5,1}{0,05} = 102 \Rightarrow R = 27(Al)$
Vậy oxit là $Al_2O_3$
Đúng 3
Bình luận (0)
1. Hoà tan 13g kẽm vào 200ml dung dịch HCl vừa đủ. Tính nồng độ mol của dung dịch HCl đã dùng và nồng độ mol chất trong dung dịch sau phản ứng.
2. Cho 7,2g một sắt oxit tác dụng với dung dịch HCl có dư sau phản ứng thi được 12,7g một muối khan. Tìm công thức phân tử của sắt oxit.
nZn=13/65=0,2mol
đổi 200ml=0,2l
pt : Zn + 2 HCl -----> ZnCl2 + H2
npứ: 0,2----->0,4---------->0,2
CM(HCl)=0,4/0,2=2M
CM(ZnCl2) = 0,2/0,2 = 1M
Đúng 0
Bình luận (0)
Bài 1:
Zn + 2HCl → ZnCl2 + H2
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}=2\times0,2=0,4\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
Theo PT: \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{ZnCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Đúng 0
Bình luận (0)
Bài 2:
Gọi CTHH của oxit là FexOy
PTHH: FexOy + 2yHCl → xFeCl\(\dfrac{2y}{x}\) + yH2O
Ta có: \(n_{FeCl_{\dfrac{2y}{x}}}=\dfrac{12,7}{56+35,5\times\dfrac{2y}{x}}=\dfrac{12,7}{56+\dfrac{71y}{x}}\left(mol\right)\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{x}n_{FeCl_{\dfrac{2y}{x}}}=\dfrac{1}{x}\times\dfrac{12,7}{56+\dfrac{71y}{x}}=\dfrac{12,7}{56x+71y}\left(mol\right)\)
⇒ \(M_{Fe_xO_y}=\dfrac{m_{Fe_xO_y}}{n_{Fe_xO_y}}=7,2\div\dfrac{12,7}{56x+71y}=\dfrac{403,2x+511,2y}{12,7}\left(g\right)\)
Ta có: \(56x+16y=\dfrac{403,2x+511,2y}{12,7}\)
\(\Leftrightarrow711,2x+203,2y=403,2x+511,2y\)
\(\Leftrightarrow308x=308y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{308}{308}=\dfrac{1}{1}\left(tốigiản\right)\)
Vậy \(x=1;y=1\)
Vậy CTHH của oxit sắt là FeO
Đúng 0
Bình luận (0)
Cho 38,4 gam một oxit axit của phi kim X có hoá trị IV tác dụng vừa đủ với với dung dịch NaOH thu được 400 gam dung dịch muối trung hoà có nồng độ 18,9% .Xác định CT của oxit .
Gọi công thức oxit axit của phi kim X là \(XO_2\).
Ta có :
\(n_{SO_2}=\dfrac{38,4}{M_X+32}mol;n_{muoi}=\dfrac{400.18,9}{100}=75,6g\)
PTHH : \(XO_2+2NaOH\rightarrow Na_2XO_3+H_2O\)
\(\rightarrow\) muối thu được là \(Na_2XO_3\) \(\Rightarrow n_{Na_2XO_3}=\dfrac{75,6}{M_X+94}\)
Nhận xét :\(n_{Na_2XO_3}=n_{XO_2}\rightarrow\dfrac{75,6}{M_X+94}=\dfrac{38,4}{M_X+32}\Rightarrow M_X=32g\)
=> X là lưu huỳnh ( S )
=> CTHH của oxit :\(SO_2.\)
Đúng 0
Bình luận (0)
Gọi CTTQ là AO2
PTHH: AO2 + 2NaOH --> Na2AO3 + H2O
Ta có: \(m_{Na_2AO_3}\) = 400 . 18,9% = 75,6g
Cứ 1 mol AO2 ---> 1 mol Na2AO3
A + 32 (g) --> A + 94 (g)
38,4g --> 75,6g
=> 75,6A + 2419,2 = 38,4A + 3609,6
=> 37,2A = 1190,4
=> A = 32 (S)
=> CT của oxit là SO2
Đúng 0
Bình luận (13)
Bài 1: Hòa tan 7 gam một kim loại R trong 200 gam dung dịch HCL vừa đủ, thu đc 206,75 gam dung dịch A. Xác định kim loại R
Bảo toàn khối lượng:
mH2 = mR+mddHCI-mddA=0,25 gam
--> nH2=0,125 mol
2R+2nHCl -> 2RCln+nH2
0,25/n ....................................0,125
--> R=7n/0,25=28n
--> n=2 và R=56: R là Fe
Đúng 0
Bình luận (1)
Cho 0,02 mol amino axit X tác dụng vừa đủ với 200ml dung dịch HCl 0,1 M thu được 3,67 gam muối khan. Mặt khác 0,02 mol X tác dụng vừa đủ với 40 gam dung dịch NaOH 4%. Công thức của X là A. (H2N)2C3H5COOH B. H2NC2C2H3(COOH)2 C. H2NC3H6COOH D. H2NC3H5(COOH)2
Đọc tiếp
Cho 0,02 mol amino axit X tác dụng vừa đủ với 200ml dung dịch HCl 0,1 M thu được 3,67 gam muối khan. Mặt khác 0,02 mol X tác dụng vừa đủ với 40 gam dung dịch NaOH 4%. Công thức của X là
A. (H2N)2C3H5COOH
B. H2NC2C2H3(COOH)2
C. H2NC3H6COOH
D. H2NC3H5(COOH)2
cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M
a) viết PTHH
b) tính thể tích dung dịch HCl đã dùng
\(n_{MgCO_3}=\dfrac{21}{84}=0,25\left(mol\right)\\ a.MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ n_{HCl}=0,25.2=0,5\left(mol\right)\\ b.V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
Đúng 2
Bình luận (0)
Xác định công thức của 2 oxit sắt A và B, biết rằng:
a) 23,2g A tan vừa đủ trong 0,8 lít dung dịch HCl 1M
b) 32g B khi khử bằng H2 tạo thành sắt và 10,8g H2O.
Hòa tan oxit của 1 kim loại R hóa trị III bằng dung dịch HCl 18,25% vừa đủ thu được dung dịch A có nồng độ % của mmuối là 23,897%. Xác định cthh của oxit trên.
CHIều nay mìnhcần gấp rồi, giúp mình vs
gọi CTC của oxit là R2O3, đặt số mol R2O3 là 0.1(mol)
R2O3+6HCl-->2RCl3+3H2O
0.1 0.6 0.2 0.3 (mol)
C%ddHCl= 0.6x36.5x100/mdd=18.25
==>mddHCl=120(g)
C%ddspu=0.2x(R+35.5x3)x100/[0.1x(2R+48)+120]=23.897
==> R=56 : Fe
Đúng 0
Bình luận (8)
đốt cháy 51,2g Cu trong oxi, sau phản ứng thu được m gam chất rắn X. Cho chất rắn hoàn tan hoàn toàn vào lương vừa đủ 600ml dung dịch HCl 2M
a) Viết PTHH xảy ra
b) Tính hiệu suất của phản ứng Cu tác dụng với oxi.
c) Tính giá trị m
\(PTHH:2Cu+O_2\rightarrow2CuO\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Ta có:
\(n_{Cu}=\frac{51,2}{64}=0,8\left(mol\right)\)
\(\Rightarrow n_{CuO\left(lt\right)}=0,8\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{HCl}=0,6.2=1,2\left(mol\right)\\n_{CuO\left(tt\right)}=\frac{1,2}{2}=0,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow H=\frac{0,6}{0,8}.100\%=75\%\)
\(\Rightarrow m=0,6.80+0,2.64=60,8\left(g\right)\)
Đúng 0
Bình luận (0)