1.
Nếu sử dụng cùng số mol các kim loại Fe Zn Mg Al tác dụng với axit sunfuric loãng dư để điều chế khí hidro thì kim loại nào phản ứng sẽ xảy ra số mol khí Hiđro nhiều nhất? 2. dùng sắt kim ***** phản ứng hoàn toàn với axit clohiđric thì cần 200 ml dung dịch axit clohiđric khí Hiđro sinh ra phản ứng vừa đủ với 20 gam CuO đun nóng nồng độ mol của dung dịch axit clohiđric là? 3. có hỗn hợp chứa 75% Fe2O3 và 25% CuO khử hoàn toàn 8 g hỗn hợp trên bằng khí clo thì khối lượng fe và Cu thu được là bao nhiêu? Giải chi tiết giúp mk vs !
Những câu hỏi liên quan
Để điều chế khí hiđro trong phòng thí nghiệm, người ta có thể dùng kim loại kẽm, magie, nhôm cho tác dụng với axit clohiđric hoặc axit sunfuric loãng. Nếu lượng khí hiđro sinh ra bằng nhau trong mỗi trường hợp thì dùng kim loại nào phản ứng với axit nào sẽ có khối lượng chất tham gia phản ứng nhỏ nhất?

Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.
Đúng 0
Bình luận (0)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng. b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất? c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 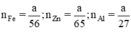
Theo pt nH2 (1) = nZn = 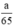 mol
mol
nH2 (2) = nFe = 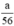 mol
mol
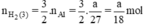
Như vậy ta nhận thấy 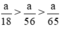 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?
c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)
Đúng 1
Bình luận (0)
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Đọc tiếp
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b, Giả sử: mZn = mAl = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
Vậy: Al cho nhiều khí H2 hơn.
c, Giả sử: nH2 (1) = nH2 (2) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=n_{H_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=27b\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{Zn}>m_{Al}\)
Vậy: Khối lượng Al đã pư nhỏ hơn.
Bài 2:
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (2)
Cho kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a. Viết các phương trình hóa học của các phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hidro nhất?
c. Nếu thu được cùng một thể tích khí hidro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
Đúng 2
Bình luận (0)
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.
Đúng 1
Bình luận (0)
Tham Khảo :
a) PTHH:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2} \\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2} \\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{H}_{2} \end{array}\)
b) Giả sử một khối lượng là \(\text{a (g)}\) kim loại kẽm sắt và nhôm cho cùng:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2}\\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2}\\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4)_{3}}+3 \mathrm{H}_{2}\right.\\ \text { Ta có } \mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} ; \mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} ; \mathrm{n}_{\mathrm{Al}}=\frac{\mathrm{a}}{27}\\ \text { Theo } \mathrm{pt} \mathrm{n}_{\mathrm{H}_{2}}(1)=\mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} \mathrm{~mol}\\ \mathrm{n}_{\mathrm{H}_{2}(2)}=\mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} \mathrm{~mol} \end{array}\)\(\begin{array}{l} \mathrm{n}_{\mathrm{H}_{2}(3)}=\frac{3}{2} \cdot \mathrm{n}_{\mathrm{A} 1}=\frac{3}{2} \cdot \frac{\mathrm{a}}{27}=\frac{\mathrm{a}}{18} \mathrm{~mol}\\ \text { Như vậy ta nhận thấy } \frac{a}{18}>\frac{a}{56}>\frac{a}{65} \Rightarrow \mathrm{n}_{H_{2}}(3)>\mathrm{n}_{\mathrm{H}_{2}}(2)>\mathrm{n}_{\mathrm{H}_{2}}(1) \end{array}\)
Vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Lấy cùng một khối lượng ban đầu các kim loại Mg,Al,Zn,Fe cho tác dụng với dung dịch H2SO4 loãng dư. Kim loại nào giải phóng lượng khí H2 nhiều nhất ở cùng điều kiện ?
A. Mg
B. Zn
C. Fe
D. Al
Đáp án : D
Khi phản ứng với H+
1 mol Al -> 1,5 mol H2
1 mol (Zn,Mg,Fe) -> 1 mol H2
Đúng 0
Bình luận (0)
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.a, Viết các phương trình phản ứngb, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ? giúp mình nhé các bạn ?
Đọc tiếp
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a, Viết các phương trình phản ứng
b, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?
c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ?
giúp mình nhé các bạn ?
Cho kim loại : Zn,Alo,Fe,Mg lần lượt tác dụng với dung dịch H2SO4 loãng. Nếu cho cùng một khối lượng kim loại trên tác dụng hết với axit ,thì kim loại nào cho nhiều khí h2 nhất
Nếu lấy cùng một lượng mỗi Kim loại Magie và sắt cho phản ứng với dung dịch axit sunfuric loãng ,thì kim loại nào cho nhiều khí hidro nhất nhất
Tỉ lệ trong ptpư của hai kim loại so với H2 như nhau nên KL nào có số mol nhiều hơn sẽ sản ra nhiều H2 hơn.
m bằng nhau mà MMg <MFe nên nMg>nFe do đó Mg sản ra nhiều H2 hơn
Đúng 2
Bình luận (1)
ta co :
pthh Mg + H2SO4 ---> MgSO4 + H2
Fe + H2SO4 ----> FeSO4 + H2
=> H2 = nhau
Đúng 0
Bình luận (1)






















