đốt cháy a gam C trong oxi thu đc 4,4, lít khhis CO2 duy nhất. xác định giá trị của a cần dùng

Những câu hỏi liên quan
1.Đốt cháy hết m gam chất A cần dùng 3,36 lít oxi ở đktc, thu được 4,4 gam CO2 và 1,8 gam H2O. Giá trị đúng của m là bao nhiêu?
2.Cho 1,2 gam magie tác dụng với dung dịch axit sunfuric H2SO4 loãng, dư. Thể tích khí hiđro (đktc) thu được là bao nhiêu?
1) \(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo ĐLBTKL: m = 4,4 + 1,8 - 0,15.32 = 1,4 (g)
2)
\(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,05------------------------->0,05
=> VH2 = 0,05.22,4 = 1,12 (l)
Đúng 4
Bình luận (0)
mO2 = ( 3,36 : 22,4 ) . 32 = 4,8 (g)
ADDLBTKL ta co :
mA + mO2 = mCO2 + mH2O
=> mA = mCO2 + mH2O - mO2
= 4,4 + 1,8 - 4,8 = 1,4 (g)
=> m= 1,4 (g)
2
nMg = 1,2 : 24 = 0,05 (mol)
pthh : Mg +H2SO4 ---> MgSO4 + H2
0,05--------------------------->0,05(mol)
=> VH2 = 0,05 .22,4 = 1,12 (l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn a gam chất hữu cơ A cần phải dùng 13,44 lít khí Oxi ở (đktc)thu được 26,4 g CO2 và 10,8 g H2 a)Xác định công thức đơn giản nhất của A b)Xác định công thức phân tử của A biết 170g/mol < MA < 190g/mol
a)
nCO2 = 26,4 : 44 = 0,6 mol => nC = 0,6 mol
nH2O = 10,8 : 18 = 0,6 mol => nH = 1,2 mol
nO = 13,44 : 22,4 = 0,6 mol
nC : nH : nO = 0,6 : 1,2 : 0,6 = 1:2:1
=> Công thức đơn giản : (CH2O)n
b) Có 170 < MA < 190
=> 170 < 30n < 190
=> 30n = 180 => n = 6
=> Công thức phân tử : C6H12O6
Đúng 1
Bình luận (0)
\(a)n_C = n_{CO_2} = \dfrac{26,4}{44} =0,6(mol)\\ n_{H_2O} = \dfrac{10,8}{18} = 0,6(mol) \Rightarrow n_H = 0,6.2 = 1,2(mol)\\ n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol) \Rightarrow n_O = 0,6.2 + 0,6 - 0,6.2 = 0,6(mol)\\ n_C : n_H : n_O = 0,6 : 1,2 : 0,6 = 1 : 2 : 1\\ CTĐGN : CH_2O\\ b) CTPT : (CH_2O)_n\\ \Rightarrow 170 < (12 + 2 + 16)n < 190 \\ \Leftrightarrow 5,6 < n < 6,3 \Rightarrow n = 6\\ CTPT : C_6H_{12}O_6\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam
C
O
2
và 5,4 gam
H
2
O
. Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A? A.
C
2
H
6
B.
C
2
H
4
C.
C...
Đọc tiếp
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam C O 2 và 5,4 gam H 2 O . Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A?
A. C 2 H 6
B. C 2 H 4
C. C 3 H 8
D. C 3 H 6
n O 2 = 11,2/32 = 0,35 mol
n C O 2 = 8,8/44 = 0,2 mol ⇒ n C = 0,2 mol
n H 2 O = 5,4/18 = 0,3 mol
⇒ n H = 2.0,3 = 0,6 mol
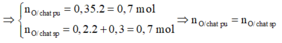
Vậy hợp chất hữu cơ A chỉ có C và H.
Gọi CTTQ của A là C x H y , khi đó ta có:
Vậy CTĐGN của A là C H 3 n
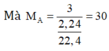
⇒ n = 30/15 = 2
Vậy A là C 2 H 6 .
⇒ Chọn A.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam chất hữu cơ A cần phải dùng 19,2 gam oxi, thu được 26,4 gam CO 2 và 10,8 gam H 2 O . Xác định công thức đơn giản nhất của A.
Sơ đồ phản ứng cháy của A :
A + O 2 → t ° CO 2 + H 2 O
Ta có: m A + m O 2 = m CO 2 + m H 2 O
→ m A = m CO 2 + m H 2 O - m O 2 = 26,4 + 10,8 - 19,2 = 18g
Khối lượng C trong 18 gam A là : 26,4/44 x 12 = 7,2g
Khối lượng H trong 18 gam A là : 10,8/18 x 2 = 1,2g
Khối lượng O trong 18 gam A lấ 18 - 7,2 - 1,2 = 9,6 (gam).
Gọi công thức hoá học của A là C x H y O z
Ta có quan hệ
12x : y : 16z = 7,2 : 1,2 : 9,6
x : y : z = 7,2/12 : 1,2/1 : 9,6/16 = 0,6 : 1,2 : 0,6 = 1 : 2 : 1
Chọn x = 1 → công thức đơn giản nhất của A là CH 2 O
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam hỗn hợp các hidrocacbon (metan, xiclohexan, butan, etilen) trong vừa đủ oxi thu được 4,48 lít CO2 (đktc) và 4,14 gam H2O. Xác định giá trị của m
Ta có: \(n_C=n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{4,14}{18}=0,23\left(mol\right)\Rightarrow n_H=0,23.2=0,46\left(mol\right)\)
⇒ m = mC + mH = 0,2.12 + 0,46.1 = 2,86 (g)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít
B. 94,2 lít
C. 80,64 lít
D. 24,9 lít
Đáp án C
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
nO2 = 3/2 n CO2 = 3/2 . 2,4 = 3,6 mol => VO2 = 3,6.22,4 = 80,64 lít
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít
B. 94,2 lít
C. 80,64 lít
D. 24,9 lít
Đáp án C
Hướng dẫn CnH2n + 3n/2O2 → nCO2 + nH2O
nO2 = 3/2 nCO2 = 3/2.2,4 = 3,6 mol => VO2 = 3,6.22,4 = 80,64 lít
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn a gam hỗn hợp gồm: eten, propen,but – 2 – en cần dùng vừa đủ b lít khí oxi ở đktc thu được 5,376 lít CO 2 ở đktc và 4,32 gam nước. Giá trị của b là:
A. 9,24
B. 9,42.
C. 8,064.
D. 2,49
- Bảo toàn nguyên tố O ta có:
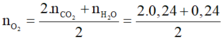
= 0,36(mol)
- Vậy b = 0,36.22,4 = 8,064 lít.
- Chọn đáp án C.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9,2g hỗn hợp gồm CH3OH , C2H5OH , C3H7OH , C4H9OH cần dùng vừa đủ 13,44 lít khí oxi(đktc) . Sau pư thu đc V lít CO2 (đktc) và m gam H2O. Giá trị V và m lần lượt là?
Đặt \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
Ta thấy các chất đều có công thức CnH2n+2O \(\Rightarrow n_{O\left(hỗnhợp\right)}=n_{H_2O}-n_{CO_2}\)
\(\Rightarrow n_{O\left(ancol\right)}=b-a\)
Ta có: \(m_{hh}=m_C+m_H+m_O=9,2\left(g\right)\) \(\Rightarrow a+2b+16\left(b-a\right)=9,2\) (1)
Mặt khác: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn oxi: \(\left(b-a\right)+2\cdot0,6=2a+b\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{CO_2}=0,4\left(mol\right)\\b=n_{H_2O}=\dfrac{38}{45}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,4\cdot22,4=8,96\left(l\right)\\m_{H_2O}=15,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)

















