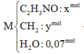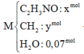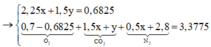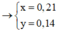Hỗn hợp A gồm khí nito và khí hidro có thể tích là 12 lít ( 200C và 1atm).Kích thích cho phản ứng xảy ra hoàn toàn được hỗn hợp khí B,đưa B và điều kiện ban đầu thì thể tích còn lại là 7,2 lít.Hãy tính tỉ khối của hỗn hợp A,B so với khí Hidro

Những câu hỏi liên quan
Dẫn 4,48 lít hỗn hợp khí gồm
N
2
v
à
C
l
2
vào dung dịch
C
a
O
H
2
dư. Sau khi phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của
C
l
2...
Đọc tiếp
Dẫn 4,48 lít hỗn hợp khí gồm N 2 v à C l 2 vào dung dịch C a O H 2 dư. Sau khi phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của C l 2 trong hỗn hợp trên là
A. 88,38%
B. 75,00%
C. 25,00%
D. 11,62%
Chọn đáp án B
Khí thoát ra là N 2 không phản ứng.
% V c l o = 4 , 48 - 1 , 12 4 , 48 . 100 % =75%
Đúng 0
Bình luận (0)
Hỗn hợp khí X gồm hiđro, một ankan và một anken. Cho 560 cm3 hỗn hợp đó đi qua Ni/t0, để phản ứng xảy ra hoàn toàn, sau đó đưa về điều kiện ban đầu về nhiệt độ và áp suất, người ta được 448 cm3 (các thể tích đo đktc) hỗn hợp khí B. Biết B làm mất màu dung dịch brom. Thể tích hiđro trong hỗn hợp X là A. 336 cm3. B. 112 cm3. C. 224 cm3. D. 672 cm3.
Đọc tiếp
Hỗn hợp khí X gồm hiđro, một ankan và một anken. Cho 560 cm3 hỗn hợp đó đi qua Ni/t0, để phản ứng xảy ra hoàn toàn, sau đó đưa về điều kiện ban đầu về nhiệt độ và áp suất, người ta được 448 cm3 (các thể tích đo đktc) hỗn hợp khí B. Biết B làm mất màu dung dịch brom. Thể tích hiđro trong hỗn hợp X là
A. 336 cm3. B. 112 cm3. C. 224 cm3. D. 672 cm3.
Do B làm mất màu dd Br2
=> Trong B còn anken
=> H2 phản ứng hết
\(V_{H_2}=560-448=112\left(cm^3\right)\)
=> B
Đúng 1
Bình luận (0)
Do B làm mất màu dd Br2
=> Trong B còn anken
=> H2 phản ứng hết
VH2=560−448=112(cm3)VH2=560−448=112(cm3)
=> B
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam hỗn hợp M (có tổng số mol 0,07 mol) gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T đều mạch hở cần dùng 15,288 lít khí O2. Nếu cho m gam hỗn hợp M tác dụng với dung dịch KOH vừa đủ rồi cô cạn cẩn thận thu được rắn E gồm hỗn hợp muối của glyxin và alanin. Đốt cháy E trong bình chứa 3,5 mol không khí. Toàn bộ khí sau phản ứng cháy sau khi được ngưng tụ hơi nước thì còn lại 75,656 lít hỗn hợp khí. Các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện t...
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp M (có tổng số mol 0,07 mol) gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T đều mạch hở cần dùng 15,288 lít khí O2. Nếu cho m gam hỗn hợp M tác dụng với dung dịch KOH vừa đủ rồi cô cạn cẩn thận thu được rắn E gồm hỗn hợp muối của glyxin và alanin. Đốt cháy E trong bình chứa 3,5 mol không khí. Toàn bộ khí sau phản ứng cháy sau khi được ngưng tụ hơi nước thì còn lại 75,656 lít hỗn hợp khí. Các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn. Trong không khí O2 chiếm 20% thể tích, còn lại là N2. Giá trị gần nhất của m là?
A. 15,20.
B. 11,40.
C. 12,60
D. 13,90.
Cho 5,6 lít hỗn hợp X gồm hai khí CO và CO2 đi qua than nóng đỏ (không có không khí) thu được 7,0 lít hỗn hợp khí Y. Dẫn Y đi qua dung dịch canxi hiđroxit dư thì thu được 6,25 gam kết tủa. Biết các thể tích khí đó ở điều kiện tiêu chuẩn, các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO2 trong hỗn hợp X và Y tương ứng là A. 25% và 25%. B. 50% và 20%. C. 50% và 25%. D. 25% và 20%.
Đọc tiếp
Cho 5,6 lít hỗn hợp X gồm hai khí CO và CO2 đi qua than nóng đỏ (không có không khí) thu được 7,0 lít hỗn hợp khí Y. Dẫn Y đi qua dung dịch canxi hiđroxit dư thì thu được 6,25 gam kết tủa. Biết các thể tích khí đó ở điều kiện tiêu chuẩn, các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO2 trong hỗn hợp X và Y tương ứng là
A. 25% và 25%.
B. 50% và 20%.
C. 50% và 25%.
D. 25% và 20%.
Đáp án B
Khi cho CO và CO2 qua than nóng đỏ dó phản ứng:
CO2 + C → 2CO ⇒ Số mol hỗn hợp tăng lên chính là số mol CO2 đã tham gia phản ứng.
⇒ nCO2 đã pứ = (7 – 5,6) ÷ 22,4 = 0,0625 mol.
Số mol CO2 còn lại = nCaCO3 = 6,25 ÷ 100 = 0,0625 mol.
⇒ nCO2 ban đầu = 0,0625 + 0,0625 = 0,125 mol.
Tóm lại nCO2/X = 0,125 mol và nCO2/Y = 0,0625
Đúng 0
Bình luận (0)
Cho 5,6 lít hỗn hợp X gồm hai khí CO và CO2 đi qua than nóng đỏ (không có không khí) thu được 7,0 lít hỗn hợp khí Y. Dẫn Y đi qua dung dịch canxi hiđroxit dư thì thu được 6,25 gam kết tủa. Biết các thể tích khí đó ở điều kiện tiêu chuẩn, các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO2 trong hỗn hợp X và Y tương ứng là A. 25% và 25%. B. 50% và 20%. C. 50% và 25%. D. 25% và 20%.
Đọc tiếp
Cho 5,6 lít hỗn hợp X gồm hai khí CO và CO2 đi qua than nóng đỏ (không có không khí) thu được 7,0 lít hỗn hợp khí Y. Dẫn Y đi qua dung dịch canxi hiđroxit dư thì thu được 6,25 gam kết tủa. Biết các thể tích khí đó ở điều kiện tiêu chuẩn, các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO2 trong hỗn hợp X và Y tương ứng là
A. 25% và 25%.
B. 50% và 20%.
C. 50% và 25%.
D. 25% và 20%.
Đáp án B
Khi cho CO và CO2 qua than nóng đỏ dó phản ứng:
CO2 + C → 2CO ⇒ Số mol hỗn hợp tăng lên chính là số mol CO2 đã tham gia phản ứng.
⇒ nCO2 đã pứ = (7 – 5,6) ÷ 22,4 = 0,0625 mol.
Số mol CO2 còn lại = nCaCO3 = 6,25 ÷ 100 = 0,0625 mol.
⇒ nCO2 ban đầu = 0,0625 + 0,0625 = 0,125 mol.
Tóm lại nCO2/X = 0,125 mol và nCO2/Y = 0,0625
Đúng 0
Bình luận (0)
Cho V lít hỗn hợp khí X gồm O2 và O3. Thực hiện phản ứng ozon phân hoàn toàn, sau một thời gian thu được khí Y và thể tích khí tăng lên 30% so với thể tích ban đầu , biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất. Phần trăm thể tích của O2 trong hỗn hợp đầu là: A. 25% B. 40% C. 50% D. 57,14%
Đọc tiếp
Cho V lít hỗn hợp khí X gồm O2 và O3. Thực hiện phản ứng ozon phân hoàn toàn, sau một thời gian thu được khí Y và thể tích khí tăng lên 30% so với thể tích ban đầu , biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất. Phần trăm thể tích của O2 trong hỗn hợp đầu là:
A. 25%
B. 40%
C. 50%
D. 57,14%
trộn h2 và o2 theo tỉ lệ về khối lượng tương ứng là 3:8 ta được hỗn hợp khí Q.Cho nổ hỗn hợp khí Q trong bình kín đến phản ứng hoàn toàn rồi đưa về nhiệt độ ban đầu thì thấy thể tích còn lại là 1.792 lít .tính thể tích khí Q đã phản ứng ở đktc.Giải đầy đủ giúp em với ạ!Em cảm ơn !
\(\dfrac{mH2}{mO2}\)=\(\dfrac{3}{8}\)=x
=>;mH2=x=>nH2=\(\dfrac{3x}{2}\)mol
m02=\(\dfrac{8x}{32}\)=\(\dfrac{x}{4}\)mol
PTHH: 2H2 + O2 to→ 2H2O
xét: \(\dfrac{3x}{2}\);\(\dfrac{3x}{12}\)
h2 dư, o2 hết
nh2dư=\(\dfrac{3x}{2}-\dfrac{3x}{12}\)\(=\dfrac{15x}{12}\)=\(\dfrac{1,792}{22,4}\)=0,08(mol)
=>x=\(\dfrac{0,08.12}{15}\)=0,064
nO2=\(\dfrac{0,064}{4}\)=0,016(mol)
nH2=\(\dfrac{0,064.3}{2}\)=0,096(mol)
VQ(đktc)=22,4(0,016+0,096)=2,5088(lít)
Đúng 2
Bình luận (0)
trộn h2 và o2 theo tỉ lệ về khối lượng tương ứng là 3:8 ta được hỗn hợp khí Q.Cho nổ hỗn hợp khí Q trong bình kín đến phản ứng hoàn toàn rồi đưa về nhiệt độ ban đầu thì thấy thể tích còn lại là 1.792 lít .tính thể tích khí Q đã phản ứng ở đktc.Giải đầy đủ giúp em với ạ!Em cảm ơn !
Gọi số mol H2, O2 là a, b (mol)
Ta có: \(\dfrac{m_{H_2}}{m_{O_2}}=\dfrac{3}{8}\)
=> \(\dfrac{2a}{32b}=\dfrac{3}{8}\Rightarrow\dfrac{a}{b}=\dfrac{6}{1}\) hay a = 6b
PTHH: 2H2 + O2 --to--> 2H2O
Xét tỉ lệ: \(\dfrac{6b}{2}>\dfrac{b}{1}\) => H2 dư, O2 hết
PTHH: 2H2 + O2 --to--> 2H2O
2b<---b
=> \(n_{H_2\left(dư\right)}=6b-2b=4b=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
=> b = 0,02 (mol)
=> a = 0,12 (mol)
=> VQ = (0,02 + 0,12).22,4 = 3,136 (l)
Đúng 4
Bình luận (0)
Trong bình kín chứa 40 ml khí oxi và 35 ml hỗn hợp khí gồm hiđro và một amin đơn chức X. Bật tia lửa điện để phản ứng cháy xảy ra hoàn toàn, rồi đưa bình về điều kiện ban đầu, thu được hỗn hợp khí có thể tích là 20 ml gồm 50% CO2, 25% N2, 25% O2. Coi hơi nước đã bị ngưng tụ. Chất X là: A. anilin B. propylamin C. etylamin D. metylamin
Đọc tiếp
Trong bình kín chứa 40 ml khí oxi và 35 ml hỗn hợp khí gồm hiđro và một amin đơn chức X. Bật tia lửa điện để phản ứng cháy xảy ra hoàn toàn, rồi đưa bình về điều kiện ban đầu, thu được hỗn hợp khí có thể tích là 20 ml gồm 50% CO2, 25% N2, 25% O2. Coi hơi nước đã bị ngưng tụ. Chất X là:
A. anilin
B. propylamin
C. etylamin
D. metylamin
Chọn đáp án D.
Đốt 35 ml (amin; H2) + 40 ml O2 → t o 10 ml CO2 + 5 ml N2 + 5 ml O2 dư.
Amin đơn chức.
⇒ Có 5 ml N2
→ Có 10 ml amin.
⇒ Trong 35 ml hỗn hợp còn 25 ml khí H2 nữa.
Chú ý: Đốt 10 ml amin cho 10 ml CO2
⇒ amin là C1 ứng với amin duy nhất là CH3NH2: metylamin.
Đúng 0
Bình luận (0)
Trong bình kín chứa 40 ml khí oxi và 35 ml hỗn hợp khí gồm hiđro và một amin đơn chức X. Bật tia lửa điện để phản ứng cháy xảy ra hoàn toàn, rồi đưa bình về điều kiện ban đầu, thu được hỗn hợp khí có thể tích là 20 ml gồm 50%CO2, 25%N2, 25%O2. Coi hơi nước đã bị ngưng tụ. Chất X là A. anilin B. propylamin C. etylamin D. metylamin
Đọc tiếp
Trong bình kín chứa 40 ml khí oxi và 35 ml hỗn hợp khí gồm hiđro và một amin đơn chức X. Bật tia lửa điện để phản ứng cháy xảy ra hoàn toàn, rồi đưa bình về điều kiện ban đầu, thu được hỗn hợp khí có thể tích là 20 ml gồm 50%CO2, 25%N2, 25%O2. Coi hơi nước đã bị ngưng tụ. Chất X là
A. anilin
B. propylamin
C. etylamin
D. metylamin
Đáp án D
Ban đầu đặt thể tích H2 là x thì thể tích amin là 35-x ml
Sau phản ứng có 10 mol CO2 và 5 ml N2, 5 ml O2
40 ml O2 + (X, H2) → H2O, CO2 : 10 ml, N2: 5 ml và còn dư 5 ml O2
Từ sơ đồ thấy có 35ml O2 tham gia vào phản ứng
Vì amin này đơn chức nên Vamin = 2VN2 = 10ml nên số C trong X là 10 :10 =1
Đúng 0
Bình luận (0)