Hòa tan 16g fe2o3 vào dung dịch có chứa 49g h2so4 .Tính khôi lượng muối thu dk
Giúp mk nha
Hòa tan 64g hỗn hợp X gồm cuo và fe2o3 vào dung dịch hcl 20% sau phản ứng, cô cạn dung dịch thu được 124,5g hỗn hợp muối khan G'
A. Tính % khối lượng từng chất trong X
B. Tính khối lượng dung dịch hcl đã dùng
a/
\(Fe_2O_3\left(x\right)+6HCl\left(6x\right)\rightarrow2FeCl_3\left(2x\right)+3H_2O\)
\(CuO\left(y\right)+2HCl\left(2y\right)\rightarrow CuCl_2\left(y\right)+H_2O\)
Gọi số mol của Fe2O3 và CuO lần lược là: x, y
Ta có: \(\left\{\begin{matrix}160x+80y=64\\162,5.2x+135y=124,5\end{matrix}\right.\)
\(\left\{\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
\(\%Fe_2O_3=\frac{160.0,3}{64}=75\%\)
\(\Rightarrow\%CuO=100\%-75\%=25\%\)
b/ \(n_{HCl}=6.0,3+2.0,2=2,2\)
\(m_{HCl}=2,2.36,5=80,3\)
\(m_{ddHCl}=\frac{80,3}{0,2}=401,5\)
Cho 6,4g hỗn hợp A gồm Fe và Mg phản ứng với 100g dung dịch H2SO4 loãng vừa đủ được 3,584 lít (đkc) và dung dịch B a, tính % theo khối lượng mỗi chất có trong A b, tính C% của từng muối trong dung dịch B c, đốt cháy 6,4g hỗn hợp A ở trên với hỗn hợp khí X gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y bằng 1 lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z thu được 56,69g kết tủa. Tính % theo thể tính của Cl2 trong hỗn hợp X
Hòa tan 6,5g Zn vào dung dịch axit H2SO4
a/Tính thể tích H2 ở đktc và khối lượng của ZnSO4
b/dẫn lượng khí H2 trên đi qua 16g Fe2O3 nung nóng.Tính khối lượng của các chất thu được sau phản ứng
a, nZn = 6,5/65 = 0,1(mol)
Zn + H2SO4 ---> ZnSO4 + H2
0,1........................................0,1
V H2(đktc)=0,1.22,4=2,24(l)
b, nFe2O3 = 16/160=0,1(mol)
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O
\(\frac{0,1}{1}>\frac{0,1}{3}\)=> Fe2O3 dư sau phản ứng và hidro phản ứng hết
nFe=0,1.2/3=0,067(mol) => mFe=0,067.56=3,752(g)
nH2O=0,1.3/3=0,1(mol) => mH2O=0,1.18=1,8(g)
nFe2O3(pư)=0,1.1/3=0,033(mol)
nFe2O3(dư)=nFe2O3 - nFe2O3(pư)=0,1-0.033=0,067(mol)
=> mFe2O3=0,067.160=10,72(g)
Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 2 : 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hòa tan là:
A. 3x
B. y
C. 2x
D. 2y
Đáp án B
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
TH1: H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2
x y
⇒Loại vì x = y
TH2: H2SO4 đặc nóng
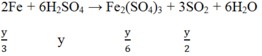
Ta có:
![]()
Do Fe dư nên tiếp tục xảy ra phản ứng:
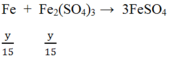
![]()
Vậy Fe hết
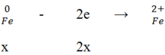
S + 2e → SO2
y y/2
Áp dụng định luật bảo toàn electron ta có: 2x = y
Hòa tan 12,8 gam hỗn hợp A gồm (Fe và Fe2O3) vào dung dịch H2SO4 loãng 0,46M dư. Sau khi phản ứng kết thúc thu được 4,48 lít khi H2 (đktc).
a/ Viết các phương trình hóa học.
b/ Tính % theo khối lượng của mỗi chất có trong hỗn hợp A.
c/ Tính thể tích H2SO4 loãng tham gia phản ứng.
\(a,Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ b,n_{Fe}=n_{H_2}=0,2\left(mol\right)\\ \%m_{Fe}=\dfrac{0,2.56}{12,8}.100\%=87,5\%\\ \%m_{Fe_2O_3}=100\%-87,5\%=12,5\%\\ c,n_{Fe_2O_3}=\dfrac{12,8-11,2}{160}=0,01\left(mol\right)\\ n_{H_2SO_4}=n_{Fe}+3n_{Fe_2O_3}=0,2+3.0,01=0,23\left(mol\right)\\ V_{ddH_2SO_4}=\dfrac{0,23}{0,46}=0,5\left(M\right)\)
hòa tan hết 22.6 gam hỗn hợp gồm Fe và các oxit sắt trong 240 gam dd HNO3 31.5% thu được dd X ( không chứa muối amoni)và hỗn hợp khí T . cho từ từ đến hết 680ml dd NaOH 1.5M vào dung dịch X thu được 32.1 gam kết tủa duy nhất. Mặt khác hòa tan hoàn toàn hết 22.16 gam hỗn hợp trên cần dùng V lít dd chứa HCl 1M và H2SO4 0.5M thu được dd Y chứa 49.09 gam muối và 1.792 lít khí H2. Nồng độ C% của muối sắt có trong dd X là
Hỗn hợp A gồm kim loại R (hóa trị I) và kim loại X (hóa trị II). Hòa tan 23,6 gam A vào dung dịch chứa H N O 3 và H 2 S O 4 thu được 20,2 gam hỗn hợp khí B gồm N O 2 và S O 2 (không còn sản phẩm khử khác). Biết V B = 8,96 lít (đktc). Khối lượng muối thu được là:
A. 25,9 gam
B. 51,8 gam
C. 61,4 gam
D. 5,18 gam
a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\)
Theo PTHH : \(n_{HCl} = 2n_{H_2} = 0,1.2 = 0,2(mol)\)
c)
Ta có :
\(n_{ZnCl_2} = n_{H_2} = 0,1(mol)\\ \Rightarrow m_{ZnCl_2} = 0,1.136 = 13.6(gam)\)
Hòa tan 3,6 gam sắt (2) oxit vào dung dịch clohidric dư.Tìm khối lượng muối clorua thu được.
nFeO=\(\frac{3,6}{56+16}=0.05\)mol
PTHH
: FeO+ 2HCl--> FeCl2+H2O
0,05--------------> 0,05
khói lượng muối clorua:
= 0,05.( 56+35.5.2)=6,35 g