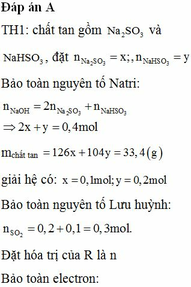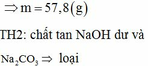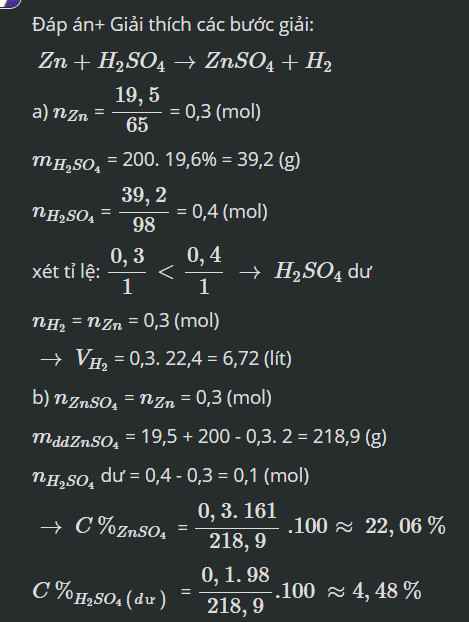Hòa tan 19,7 g BaCO3 vào 200g dung dịch chứa 19,6 gam H2SO4.Tính C% của dung dịch thu được .

Những câu hỏi liên quan
Cho 400 gam dung dịch KOH 7% vào 100 gam dung dịch H2SO4 19,6%. Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng.
\(n_{KOH}=\dfrac{400.7\%}{56}=0,5\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{100.19,6\%}{98}=0,2\left(mol\right)\)
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
Xét tỉ lệ: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\) => KOH dư, H2SO4 hết
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
0,4<----0,2-------->0,2
=> \(\left\{{}\begin{matrix}m_{KOH\left(dư\right)}=\left(0,5-0,4\right).56=5,6\left(g\right)\\m_{K_2SO_4}=0,2.174=34,8\left(g\right)\end{matrix}\right.\)
mdd sau pư = 400 + 100 = 500 (g)
=> \(\left\{{}\begin{matrix}C\%_{KOH.dư}=\dfrac{5,6}{500}.100\%=1,12\%\\C\%_{K_2SO_4}=\dfrac{34,8}{500}.100\%=6,96\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 400 gam dung dịch KOH 7% vào 100 gam dung dịch H2SO4 19,6%. Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng
\(n_{KOH}=\dfrac{400.7}{100}:56=0,5\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{100.19,6}{100}:98=0,2\left(mol\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,4 0,2 0,2
Lập tỉ lệ:
\(\dfrac{0,5}{2}>\dfrac{0,2}{1}\) => KOH dư.
\(m_{dd}=400+100=500\left(g\right)\)
\(n_{KOH.dư}=0,5-0,4=0,1\left(mol\right)\)
\(C\%_{K_2SO_4}=\dfrac{0,2.174.100}{500}=6,96\%\)
\(C\%_{KOH}=\dfrac{0,1.56.100}{500}=1,12\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 11,2 gam một kim loại R bằng dung dịch H2SO4, thu được khí SO2. Cho toàn bộ lượng khí này hấp thụ hết vào 400 ml dung dịch NaOH 1M, thu được dung dịch chứa 33,4 gam chất tan. Mặt khác, hòa tan hoàn toàn 19,6 gam kim loại R vào 160 ml dung dịch HCl 2M thu được dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là A. 57,8. B. 45,92. C. 54,6 D. 83,72
Đọc tiếp
Hòa tan hoàn toàn 11,2 gam một kim loại R bằng dung dịch H2SO4, thu được khí SO2. Cho toàn bộ lượng khí này hấp thụ hết vào 400 ml dung dịch NaOH 1M, thu được dung dịch chứa 33,4 gam chất tan. Mặt khác, hòa tan hoàn toàn 19,6 gam kim loại R vào 160 ml dung dịch HCl 2M thu được dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 57,8.
B. 45,92.
C. 54,6
D. 83,72
Hòa tan 24 gam Fe2O3 vào 200g dung dịch H2SO4 14,7% thu được dung dịch A
a) Viết các PTHH
b) Tính nồng độ % của chất tan trong dung dịch A
\(a.Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ b.n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\\ n_{H_2SO_4}=3.0,15=0,45\left(mol\right)\\ m_{ddH_2SO_4}=\dfrac{0,45.98.100}{14,7}=300\left(g\right)\\ m_{ddsau}=24+300=324\left(g\right)\\ n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,15\left(mol\right)\\ C\%_{ddFe_2\left(SO_4\right)_3}=\dfrac{0,15.400}{324}.100\approx18,519\%\)
Đúng 5
Bình luận (0)
Hòa tan hoàn toàn 8,1g ZnO vào 200g dung dịch H2SO4 19,6% thu dung dịch A hãy
1) Viết phương trình hóa học
2) Chất nào còn dư khối lượng là bao nhiêu
3) Tính nồng độ phần trăm của các chất trong dung dịch A thu được
\(n_{ZnO}=\dfrac{8,1}{81}=0,1\left(mol\right)\\ n_{H_2SO_4}=\dfrac{19,6\%.200}{98}=0,4\left(mol\right)\\a, ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\\ b,Vì:\dfrac{0,1}{1}< \dfrac{0,4}{1}\\ \Rightarrow H_2SO_4dư\\ n_{H_2SO_4\left(p.ứ\right)}=n_{ZnSO_4}=n_{ZnO}=0,1\left(mol\right)\\ n_{H_2SO_4\left(dư\right)}=0,4-0,1=0,3\left(mol\right)\\ \Rightarrow m_{H_2SO_4\left(dư\right)}=98.0,3=29,4\left(g\right)\\ c,n_{ZnSO_4}=0,1.161=16,1\left(g\right)\\ m_{ddsau}=m_{ZnO}+m_{ddH_2SO_4}=8,1+200=208,1\left(g\right)\\ \Rightarrow C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{29,4}{208,1}.100\approx14,128\%\\ C\%_{ddZnSO_4}=\dfrac{16,1}{208,1}.100\approx7,737\%\)
Đúng 2
Bình luận (0)
ZnO+H2SO4->ZnSO4+H2O
0,1-----0,1-------0,1-------0,1 mol
n ZnO=\(\dfrac{8,1}{81}\)=0,1 mol
m H2SO4 =39,2g =>n H2SO4=\(\dfrac{39,2}{98}\)=0,4 mol
=>H2SO4 , dư 0,3 mol
=>m H2SO4=0,3.98=29,4g
=>C%H2SO4 dư=\(\dfrac{29,4}{200+0,1.18}\).100=14,568%
=>C% ZnSO4=\(\dfrac{0,1.161}{200+0,1.18}.100=7,9781\%\)
Đúng 0
Bình luận (0)
a) Tìm công thức của oxit sắt trong đó sắt chiếm 70% về khối lượng
b) Đem oxit trên cho tan vào 200g dung dịch H2SO4 19,6% vừa đủ. Tính CM của dung dịch thu được sau phản ứng
a) Gọi CTHH của ôxit sắt là: FexOy
Theo đề bài ra ta có: 56x : (56x + 16y) = 70%
<=> 5600x = 3920x + 1120y
<=> 1680x = 1120y => x:y = 2 : 3
Công thức hoá học của ôxit sắt là: Fe2O3
b) PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2 ↑
Khối lượng chất tan H2SO4 là: 200 . 19,6% = 39,2 gam
Số mol của H2SO4 là: 39,2 : 98 = 0,4 mol
Số mol của Fe2O3 là: 2/15 mol => mFe2O3 = 21,3 gam
Số mol của Fe2(SO4)3 là: 2/15 => mFe2(so4)3 = 53,3 gam
Số mol của H2 là: 0,4 => mH2 = 0,8 gam
Khối lượng dung dịch sau phản ứng là:
21,3 + 200 - 0,8 = 220,5 gam
C% = (53,3 : 220,5).100% = 24,2%
Đúng 0
Bình luận (0)
Cho 19,5 gam Zn vào 200 gam dung dịch H2SO4 19,6%, sau khi phản ứng xảy ra hoàn toàn:
a) Tính thể tích khí H2 thu được ở đktc.
b) Tính C% các chất tan có trong dung dịch sau phản ứng.
\(a,n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ m_{H_2SO_4}=200.19,6\%=39,2\left(g\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
bđ 0,3 0,4
pư 0,3 0,3
spư 0 0,1 0,3 0,3
\(\rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,m_{dd}=19,5+200-0,3.2=218,9\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,3.161}{218,9}.100\%=22,06\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,1.98}{218,9}.100\%=4,48\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 200 gam dung dịch H2 SO4 19,6% vào 200g dịch bari clorua 5,2% a) tính khối lượng kết tủa thu được b) Tính nồng độ phần trăm của các chất trong dung dịch thu được
\(m_{ct}=\dfrac{19,6.200}{100}=39,2\left(g\right)\)
\(n_{H2SO4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
\(m_{ct}=\dfrac{5,2.200}{100}=10,4\left(g\right)\)
\(n_{BaCl2}=\dfrac{10,4}{208}=0,05\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,4 0,05 0,1 0,05
a) Lập tỉ số so sánh: \(\dfrac{0,4}{1}>\dfrac{0,05}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{BaSO4}=0,05.233=11,65\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,05.2}{1}=0,1\left(mol\right)\)
⇒ \(m_{HCl}=0,1.36,5=3,65\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,4-0,05=0,35\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,35.98=34,3\left(g\right)\)
\(m_{ddspu}=200+200-11,65=388,35\left(g\right)\)
\(C_{ddHCl}=\dfrac{3,65.100}{388,35}=0,94\)0/0
\(C_{ddH2SO4\left(dư\right)}=\dfrac{34,3.100}{388,35}=8,83\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
\(a.n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\\ n_{BaCl_2}=\dfrac{200.5,2\%}{208}=0,05\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ Vì:\dfrac{0,05}{1}< \dfrac{0,4}{1}\\ \Rightarrow H_2SO_4dư\\ n_{BaSO_4}=n_{BaCl_2}=0,05\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{BaSO_4}=0,05.233=11,65\left(g\right)\\ b.m_{ddsau}=200+200-11,65=388,35\left(g\right)\\ C\%_{ddHCl}=\dfrac{0,05.2.36,5}{388,35}.100\approx0,94\%\\ C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{\left(0,4-0,05\right).98}{388,35}.100\approx8,832\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn tàn CuO với 200 gam dung dịch H2SO4 19,6% thu được dung dịch A. Cho toàn bộ lượng A phản ứng với dung dịch NaOH thu được 29,4 gam kết tủa và dung dịch B. Tính nồng độ phần trăm chất tan có trong dung dịch B
\(n_{H_2SO_4}=\dfrac{200.19,6}{100.98}=0,4mol\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4\left(A\right)}=n_{CuO}=n_{H_2SO_4}=0,4mol\\ n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\\\Rightarrow\dfrac{0,4}{1}>\dfrac{0,3}{1}\Rightarrow CuSO_4.pư.không.hết\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,3mol 0,6mol 0,3mol
\(m_{ddB}=0,4.80+200+0,6.40-29,4=226,6g\\ C_{\%Na_2SO_4\left(B\right)}=\dfrac{0,3.142}{226,6}\cdot100=18,8\%\)
Đúng 3
Bình luận (5)