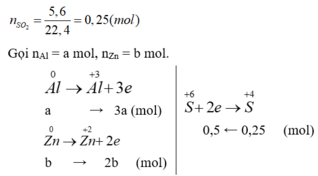Cho 12g hỗn hợp Cu và Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng thu được 5,6 lít khí SO2 (đktc) (sản phẩm khử duy nhất)
a,viết phương trình hóa học phản ứng
b,tính khối lượng Cu và Fe trong hỗn hợp ban đầu
c,tính khối lượng muối thu được
(K=39,Cl=35,5,Mg=24,Na=23,Cu=64,Fe=56,S=32,O=16)
Các bạn giải giúp tớ trước 12h thì tốt quá cảm ơn các cậu