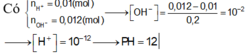Đổ 100ml dung dịch HCL 0.001M vào 400ml dung dịch NaOH 0.000375M. Tính pH dung dịch thu được.

Những câu hỏi liên quan
Trộn 100ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Tính pH của dung dịch X ?
A. 1
B. 2
C. 3
D. 4
Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2
Đúng 1
Bình luận (0)
Bài 5. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M thu được dung dịch A. Tính nồng độ mol các chất tan trong dung dịch A.Bài 6. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M ta thu được dung dịch A. Tính nồng độ mol các chất trong dung dịch A.Bài 7. Trộn 300ml dung dịch Ba(OH)2 1M với 200ml dung dịch H2SO4 1M ta thu được dung dịch A và mg kết tủa. Tính giá trị của m và nồng độ mol các chất trong dd A.Bài 8. Trộn 200ml dung dịch Na2CO3 với 300ml dung...
Đọc tiếp
Bài 5. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M thu được dung dịch A. Tính nồng độ mol các chất tan trong dung dịch A.
Bài 6. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M ta thu được dung dịch A. Tính nồng độ mol các chất trong dung dịch A.
Bài 7. Trộn 300ml dung dịch Ba(OH)2 1M với 200ml dung dịch H2SO4 1M ta thu được dung dịch A và mg kết tủa. Tính giá trị của m và nồng độ mol các chất trong dd A.
Bài 8. Trộn 200ml dung dịch Na2CO3 với 300ml dung dịch HCl 1M ta thu được dung dịch A và V lít khí CO2 ở đktc. Tính V và nồng độ mol các chất trong dung dịch A.
các bạn giúp mình với ạ
trộn 100ml dung dịch naoh 0.2M với 400ml dung dịch ba(oh)2 0.1 thu được dung dịch a a] tính Ph dung dịch a b]cho 500ml dung dịch hcl 0.3m vào 500ml dung dịch a thu được dung dịch b.tính ph dung dịch b
a, \(n_{OH^-}=0,2.0,1+0,1.2.0,4=0,1\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,1}{0,5}=0,2M\)
\(\Rightarrow\left[H^+\right]=5.10^{-14}M\)
\(\Rightarrow pH\approx13,3\)
Đúng 0
Bình luận (0)
b, \(n_{H^+}=0,15\left(mol\right)\)
\(\Rightarrow n_{H^+dư}=0,05\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,05}{1}=0,05M\)
\(\Rightarrow pH\approx1,3\)
Đúng 0
Bình luận (0)
Cho 400ml dung dịch Ca(OH)2 1M vào 100ml dung dịch HCl 1M
a) Tính khối lượng muối thu được
b) CM dung dịch thu được sau phản ứng
a) \(n_{Ca\left(OH\right)_2}=0,4\left(mol\right);n_{HCl}=0,1\left(mol\right)\)
\(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
0,4................0,1
Lập tỉ lệ : \(\dfrac{0,4}{1}< \dfrac{0,1}{2}\) => Ca(OH)2 dư sau phản ứng
\(n_{CaCl_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
=> \(m_{CaCl_2}=0,05.111=5,55\left(g\right)\)
b) Dung dịch thu được sau phản ứng CaCl2 và Ca(OH)2 dư
\(n_{Ca\left(OH\right)_2}=0,4-0,05=0,35\left(mol\right)\)
\(CM_{CaCl_2}=\dfrac{0,05}{0,4+0,1}=0,1M\)
\(CM_{Ca\left(OH\right)_2}=\dfrac{0,35}{0,4+0,1}=0,7M\)
Đúng 2
Bình luận (0)
400ml = 0,4l
100ml = 0,1l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,4=0,4\left(mol\right)\)
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,1=0,1\left(mol\right)\)
Pt : Ca(OH)2 + 2HCl → CaCl2 + 2H2O\(|\)
1 2 1 2
0,4 0,1 0,05
a) Lập tỉ số so sánh : \(\dfrac{0,4}{1}>\dfrac{0,1}{2}\)
⇒ Ca(OH)2 dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
Số mol của muối canxi clorua
nCaCl2 = \(\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
Khối lượng của muối canxi clorua
mCaCl2= nCaCl2 . MCaCl2
= 0,05 . 111
= 5,55 (g)
b) Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 0,4 + 0,1 = 0,5 (l)
Nồng độ mol của canxi clorua
CMCaCl2 = \(\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (1)
Tính số mol, nồng độ mol ion H+ và OH- và pH của dung dịch axit b) HNO3 0,04M c) dung dịch HCl 0.001M d) dung dịch H2SO4 0,003M e) dung dịch HNO3 có pH=2 f) dung dịch H2SO4 có pH=4 g) 200ml dung dịch H2SO4 0,01M + 100ml dung dịch HCl 0,05M Giúp em với ạ
Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là: A. 13 B. 2 C. 12 D. 7
Đọc tiếp
Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:
A. 13
B. 2
C. 12
D. 7
Trộn 100ml dung dịch HCl 0,05M với 100ml dung dịch NaOH 0,07M. Tính pH của dung
dịch thu được sau phản ứng?
\(H^++OH^-\rightarrow H_2O\\ n_{H^+}=0,05\left(mol\right);n_{OH^-}=0,07\left(mol\right)\\ Lậptỉlệ:\dfrac{0,05}{1}< \dfrac{0,07}{1}\\ \Rightarrow OH^-dư\\ \left[OH^-_{dư}\right]=\dfrac{0,07-0,05}{0,2}=0,1M\\ \Rightarrow pOH=-log\left(0,1\right)=1\\ \Rightarrow pH=14-1=13\)
Đúng 1
Bình luận (0)
Tính pH:
a) thêm 90ml H2O vào 10ml dunh dịch HCl cos pH=2. thu được 100ml dung dịch HCl có pH bằng bao nhiêu?
b) trộn 100ml dung dịch HCl có pH=2 với 100ml dung dịch HCl có pH=3 thu được 200ml dung dịch HCl có pH bằng bao nhiêu?
c) trộn 300ml dung dịch NaOH 0,01M với 200ml dung dịch HCl 0,01M thu được dung dịch có pH bằng bao nhiêu ?
a. nHCl = 10-2. 0,01 = 10-4 mol
=> Nồng độ H+ sau pha = 10-4: (0,09 + 0,01) = 10-3 => pH dd sau pha = 3
b. nồng độ H+ sau pha = [(10-2. 0,1) + (10-3. 0,1)] : 0,2 = 0,0055M
=> pH dd sau pha = -lg(0,0055) = 2,26
c. nOH- = 0,3. 0,01 = 0,003. nH+ = 0,2. 0,01 = 0,002
=> OH- dư = 0,003 - 0,002 = 0,001 => nồng độ OH- = 0,001: (0,3+0,2) = 0,002M => pOH = -lg0,002 = 2,7 => pH = 14 - 2,7 = 11,3
Đúng 0
Bình luận (0)
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X? A. 8 B. 14 C. 12 D. 13
Đọc tiếp
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X?
A. 8
B. 14
C. 12
D. 13
Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)