tại sao khi phân huỷ KMnO4 ta phải đặt nghiêng ống nghiệm

Những câu hỏi liên quan
a. Khí O2 được thu bằng phương pháp gì? Phương pháp này dựa trên tính chất nào của O2?
b. Tại sao miệng ống nghiệm lại bố trí hơi nghiêng xuống? Vai trò của miếng bông đặt ở gần miệng ống nghiệm?
c. Khi ngừng thu khí ta phải tháo rời ống nghiệm trước hay tắt đèn cồn trước? Giải thích?
a) Phương pháp đẩy nước . Phương pháp này dựa vào tính không tan trong nước
b) Vì khí nặng hơn không khí phải hơi nghiêng để khí oxi dễ thoát ra ngoài.
c) Tháo ống dẫn khí trước khi tắt đèn cồn vì nếu không tháo ống trước thì khi tắt đèn áp suất thay đổi làm nước bị hút vào gây vỡ ống nghiệm
Đúng 1
Bình luận (0)
Cho hình vẽ điều chế oxi trong phòng thí nghiệm: – Viết phương trình hóa học của phản ứng. – Vì sao có thể thu khí oxi bằng phương pháp đẩy nước? – Vì sao miệng ống nghiệm đựng KMnO4 lắp hơi nghiêng xuống? – Nêu vai trò của bông khô? – Khi dừng thí nghiệm nên tắt đèn cồn trước hay tháo ống dẫn khí ra trước? Tại sao?
Đọc tiếp
Cho hình vẽ điều chế oxi trong phòng thí nghiệm:
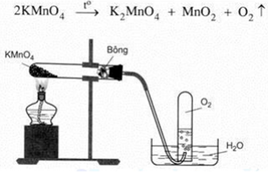
– Viết phương trình hóa học của phản ứng.
– Vì sao có thể thu khí oxi bằng phương pháp đẩy nước?
– Vì sao miệng ống nghiệm đựng KMnO4 lắp hơi nghiêng xuống?
– Nêu vai trò của bông khô?
– Khi dừng thí nghiệm nên tắt đèn cồn trước hay tháo ống dẫn khí ra trước? Tại sao?
– Dùng phương pháp đẩy nước là hợp lí vì oxi ít tan trong nước và oxi thu được có độ tinh khiết cao.
– Oxi nặng hơn không khí, khi đốt nóng KMnO4 thì áp suất tại đó cao hơn nên
– Oxi sinh ra sẽ di chuyển xuống phía dưới ống nơi áp suất thấp hơn và dễ dàng thoát ra ống dẫn khí. – Bông khô có vai trò hút ẩm.
– Khi dừng thí nghiệm nên tắt đèn cồn trước sau đó mới tháo ống dẫn khí.
Đúng 0
Bình luận (0)
Có 5 ống nghiệm A, B, C, D, E. Mỗi ống có chứa 12,4 gam đồng(II) cacbonat
CuCO
3
. Khi đun nóng, muối này bị phân huỷ dần :
CuCO
3
(r)
→
t
°
CuO(r) +
CO
2
(k)Mỗi ống được nung nóng, đế nguội và cân chất rắn còn lại trong ốn...
Đọc tiếp
Có 5 ống nghiệm A, B, C, D, E. Mỗi ống có chứa 12,4 gam đồng(II) cacbonat CuCO 3 . Khi đun nóng, muối này bị phân huỷ dần :
CuCO 3 (r) → t ° CuO(r) + CO 2 (k)
Mỗi ống được nung nóng, đế nguội và cân chất rắn còn lại trong ống nghiệm. Sau đó, thí nghiệm trên lại được lạp lại 3 lần nữa để CuCO 3 bị phân huỷ hết. Các kết quả được ghi lại như sau :
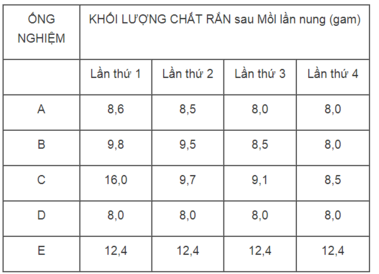
Hãy dùng những kết quả ở bảng trên để trả lời những câu hỏi sau :
1. Ống nghiệm nào đã bị bỏ quên, không đun nóng ?
2. Ống nghiệm nào có kết quả cuối cùng dự đoán là sai ? Vì sao ?
3. Vì sao khối lượng chất rắn trong ống nghiêm A là không đổi sau lần nung thứ 3 và thứ 4 ?
4. Ống nghiệm nào mà toàn lượng đồng(II) cacbonat đã bị phân huỷ sau lần nung thứ nhất ?
1. Ống nghiệm E (khối lượng CuCO 3 không thay đổi).
2. Ống nghiệm C, vì khác với các kết quả của những ống nghiệm A, B, D.
3. Sau lần nụng thứ 3 thì toàn lượng CuCO 3 đã bị phân huỷ hết thành CuO.
4. Ống nghiệm D.
Đúng 0
Bình luận (0)
Cho các phát biểu về yêu cầu kĩ thuật khi đun nóng một chất lỏng trong ống nghiệm: (1) Chất lỏng không được quá 1/3 ống nghiệm. (2) Khi đun hóa chất, phải hơ qua ống nghiệm để ống giãn nở đều. Sau đó đun trực tiếp tại nơi có hóa chất, nghiêng ống nghiệm 45o và luôn lắc đều. (3) Tuyệt đối không được hướng miệng ống nghiệm khi đun vào người khác. (4) Khi tắt đèn cồn tuyệt đối không thổi, phải dùng nắp đậy lại. Số phát biểu đúng là A. 2. B. 4. C. 3. D. 1.
Đọc tiếp
Cho các phát biểu về yêu cầu kĩ thuật khi đun nóng một chất lỏng trong ống nghiệm:
(1) Chất lỏng không được quá 1/3 ống nghiệm.
(2) Khi đun hóa chất, phải hơ qua ống nghiệm để ống giãn nở đều. Sau đó đun trực tiếp tại nơi có hóa chất, nghiêng ống nghiệm 45o và luôn lắc đều.
(3) Tuyệt đối không được hướng miệng ống nghiệm khi đun vào người khác.
(4) Khi tắt đèn cồn tuyệt đối không thổi, phải dùng nắp đậy lại.
Số phát biểu đúng là
A. 2.
B. 4.
C. 3.
D. 1.
Đáp án B
(1) Chất lỏng không được quá 1/3 ống nghiệm.
(2) Khi đun hóa chất, phải hơ qua ống nghiệm để ống giãn nở đều. Sau đó đun trực tiếp tại nơi có hóa chất, nghiêng ống nghiệm 45o và luôn lắc đều.
(3) Tuyệt đối không được hướng miệng ống nghiệm khi đun vào người khác.
(4) Khi tắt đèn cồn tuyệt đối không thổi, phải dùng nắp đậy lại.
Đúng 0
Bình luận (0)
Cho các phát biểu về yêu cầu kĩ thuật khi đun nóng một chất lỏng trong ống nghiệm: (1) Chất lỏng không được quá 1/3 ống nghiệm. (2) Khi đun hóa chất, phải hơ qua ống nghiệm để ống giãn nở đều. Sau đó đun trực tiếp tại nơi có hóa chất, nghiêng ống nghiệm 45o và luôn lắc đều. (3) Tuyệt đối không được hướng miệng ống nghiệm khi đun vào người khác. (4) Khi tắt đèn cồn tuyệt đối không thổi, phải dùng nắp đậy lại. Số phát biểu đúng là A. 2. B. 4. C. 3. D. 1.
Đọc tiếp
Cho các phát biểu về yêu cầu kĩ thuật khi đun nóng một chất lỏng trong ống nghiệm:
(1) Chất lỏng không được quá 1/3 ống nghiệm.
(2) Khi đun hóa chất, phải hơ qua ống nghiệm để ống giãn nở đều. Sau đó đun trực tiếp tại nơi có hóa chất, nghiêng ống nghiệm 45o và luôn lắc đều.
(3) Tuyệt đối không được hướng miệng ống nghiệm khi đun vào người khác.
(4) Khi tắt đèn cồn tuyệt đối không thổi, phải dùng nắp đậy lại.
Số phát biểu đúng là
A. 2.
B. 4.
C. 3.
D. 1.
Có 5 ống nghiệm A, B, C, D, E. Mỗi ống có chứa 12,4 gam đồng(II) cacbonat
CuCO
3
. Khi đun nóng, muối này bị phân huỷ dần :
CuCO
3
(r)
→
t
°
CuO(r) +
CO
2
(k)Mỗi ống được nung nóng, đế nguội và cân chất rắn còn lại trong ốn...
Đọc tiếp
Có 5 ống nghiệm A, B, C, D, E. Mỗi ống có chứa 12,4 gam đồng(II) cacbonat CuCO 3 . Khi đun nóng, muối này bị phân huỷ dần :
CuCO 3 (r) → t ° CuO(r) + CO 2 (k)
Mỗi ống được nung nóng, đế nguội và cân chất rắn còn lại trong ống nghiệm. Sau đó, thí nghiệm trên lại được lạp lại 3 lần nữa để CuCO 3 bị phân huỷ hết. Các kết quả được ghi lại như sau :
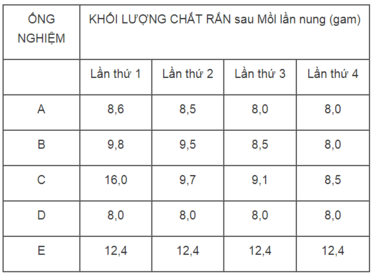
Hãy tính toán để chứng minh kết quả thí nghiệm của những ống nghiệm nào là đúng.
Phần tính toán :
Theo phương trình hoá học :
124 gam CuCO 3 sau khi bị phân huỷ sinh ra 80 gam CuO.
Vậy 12,4 gam CuCO 3 sau khi bị phân huỷ sinh ra :
m CuO = 80x12,4/124 = 8g
Thí nghiệm được tiến hành trong các ống nghiệm A, B, D là đúng.
Đúng 0
Bình luận (0)
Chuẩn bị: hexane, dung dịch KMnO4 1%; ống nghiệm, bát sứ, que đóm.Tiến hành:1. Phản ứng của hexane với dung dịch KMnO4Cho khoảng 1 mL hexane vào ống nghiệm, thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút. Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.2. Phản ứng đốt cháy hexaneCho khoảng 1 mL hexane (lưu ý không được lấy nhiều hơn) vào bát sứ nhỏ, c...
Đọc tiếp
Chuẩn bị: hexane, dung dịch KMnO4 1%; ống nghiệm, bát sứ, que đóm.
Tiến hành:
1. Phản ứng của hexane với dung dịch KMnO4
Cho khoảng 1 mL hexane vào ống nghiệm, thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút. Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.
2. Phản ứng đốt cháy hexane
Cho khoảng 1 mL hexane (lưu ý không được lấy nhiều hơn) vào bát sứ nhỏ, cẩn thận đưa que đóm đang cháy vào bề mặt chất lỏng, hexane bốc cháy cho ngọn lửa màu vàng.
Trả lời câu hỏi:
a) Hexane có phản ứng với dung dịch KMnO4 ở điều kiện thường không? Tại sao?
b) Tại sao lại đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh? Viết phương trình hoá học của phản ứng xảy ra.
c) Nếu đốt cháy hexane trong điều kiện thiếu oxygen sẽ tạo ra carbon monoxide và nước. Hãy viết phương trình hoá học của phản ứng này.
Tham khảo:
a) Hexane không phản ứng với dung dịch KMnO4 ở điều kiện thường. Do ở phân tử hexane chỉ có các liên kết đơn C – C và C – H, đó là các liên kết σ bền vững, vì thế hexane tương đối trơ về mặt hoá học, không phản ứng với chất oxi hoá mạnh như KMnO4.
b) Đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh do phản ứng này toả ra lượng nhiệt lớn có thể làm vỡ cốc thuỷ tinh.
- Phương trình hoá học minh hoạ:
C6H14+\(\dfrac{19}{2}\)O2\(^{ }\underrightarrow{t^o}\)6CO2+7H2O
c) Đốt cháy hexane trong điều kiện thiếu oxygen:
C6H14+\(\dfrac{13}{2}\)O2\(\underrightarrow{t^o}\)6CO+7H2O
Đúng 0
Bình luận (0)
Khi lắp hệ thống điều chế oxi, ta phải đặt ống nghiệm chứa hóa chất như hình nào dưới đây? A. (III). B. (II). C. (II) và (III). D. (I).
Đọc tiếp
Khi lắp hệ thống điều chế oxi, ta phải đặt ống nghiệm chứa hóa chất như hình nào dưới đây?
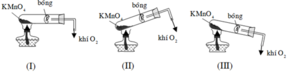
A. (III).
B. (II).
C. (II) và (III).
D. (I).
Đáp án A
Vì khí O 2 nặng hơn không khí nên phải đặt ống nghiệm như hình (III) để oxi thoát ra dễ hơn.
Đúng 0
Bình luận (0)
Khi lắp hệ thống điều chế oxi, ta phải đặt ống nghiệm chứa hóa chất như hình nào dưới đây? A. (III). B. (II). C. (II) và (III). D. (I).
Đọc tiếp
Khi lắp hệ thống điều chế oxi, ta phải đặt ống nghiệm chứa hóa chất như hình nào dưới đây?
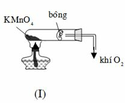
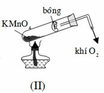
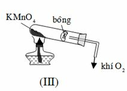
A. (III).
B. (II).
C. (II) và (III).
D. (I).










