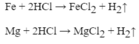Cho 2,4g Mg tác dụng với dung dịch HCl 20% . Tính nồng độ % sau phản ứng

Những câu hỏi liên quan
Cho 2,4g Mg tác dụng với 500g dung dịch HCl 36,5%
a, Viết phương trình
b, Chất nào còn dư sau phản ứng, khối lượng dư là bao nhiêu
c, Tính thể tích khí hidro thoát ra ở đktc
d, Tính nồng độ phần trăm các chất thu được sau phản ứng
a. \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b. \(n_{Mg}=\dfrac{2.4}{24}=0.1mol\)
\(mct_{HCl}=\dfrac{500\times36.5}{100}=182.5g\Rightarrow n_{HCl}=\dfrac{182.5}{36.5}=5mol\)
Ta có: \(\dfrac{0.1}{1}< \dfrac{5}{2}\Rightarrow\) HCl dư
nHCl phản ứng = 0.2 mol => nHCl dư = 5 - 0.2 = 4.8 mol
mHCl dư = \(4.8\times36.5=175.2g\)
c. \(V_{H_2}=0.1\times22.4=2.24l\)
d. mdd sau phản ứng = \(2.4+500-0.1\times2=502.2g\)
\(C\%_{MgCl_2}=\dfrac{0.1\times95\times100}{502.2}=1.89\%\)
Đúng 2
Bình luận (0)
Cho 2,4g Mg tác dụng với 100g dung dịch axit clohidric có chứa 0,4 mol axit HCl.
a. Viết phản ứng xảy ra, tính thể tích Hidro thu được sau phản ứng,
b. tính nồng độ % ( C%) các chất có trong dung dịch sau phản ứng.
Giúp mình với ạ !!
Mg+2HCl->MgCl2+H2
0,1---0,2-----0,1-----0,1
n Mg=0,1 mol
=>VH2=0,1.22,4=2,24l
C% HCl dư=\(\dfrac{0,2.36,5}{100}100\)=7,3%
=>C%MgCl2=\(\dfrac{0,1.95}{2,4+100-0,1.2}100=9,29\%\)
Đúng 3
Bình luận (2)
\(n_{Mg}=\dfrac{2,4}{24}=0,1mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 < 0,4 ( mol )
0,1 0,2 0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(C\%_{HCl}=\dfrac{0,2.36,5}{100}.100\%=7,3\%\)
\(C\%_{MgCl_2}=\dfrac{0,1.95}{2,4+100-0,1.2}.100\%=9,29\%\)
Đúng 2
Bình luận (1)
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,2 0,1 0,1
\(V_{H_2\left(\text{đ}ktc\right)}=0,1.22,4=2,24\left(L\right)\\
V_{\text{đ}kt}=0,1.24=2,4l\\
V_{H_2\left(\text{đ}kc\right)}=0,1.24,79=2,479l\)
\(m_{\text{dd}}=2,4+100-0,2=102,2\left(g\right)\\ m_{MgCl_2}=95.0,1=9,5g\\ C\%=\dfrac{9,5}{102,2}.100\%=9,3\%\)
\(C\%_{HCl\left(d\right)}=\dfrac{0,2.36,5}{100}.100=7,3\%\)
Đúng 2
Bình luận (1)
Cho Mg tác dụng vừa đủ với 200ml dung dịch HCl. Sau phản ứng thu được
2,24 lít H2 (đktc).
a. Tính khối lượng muối thu được.
b. Tính nồng độ mol dung dịch HCl đã phản ứng.
a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,1<-0,2------<0,1<---0,1
=> mMgCl2 = 0,1.95 = 9,5 (g)
b) \(C_{M\left(HCl\right)}=\dfrac{0,2}{0,2}=1M\)
Đúng 2
Bình luận (0)
cho 2,4g Mg tác dụng với dung dịch H2SO4 19,6% vừa đủ.a) Viết phương trình hoá họcb) tính thể tích khí thoát ra ở điều kiện chuẩn.c) Tính khối lượng dung dịch H2SO4.d) tính nồng độ phân trăm dung dịch thu được sau phản ứng.
Xem chi tiết
a, \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b, \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{MgSO_4}=n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.24,79=2,479\left(l\right)\)
c, \(m_{ddH_2SO_4}=\dfrac{0,1.98}{19,6\%}=50\left(g\right)\)
d, Ta có: m dd sau pư = 2,4 + 50 - 0,1.2 = 52,2 (g)
\(\Rightarrow C\%_{MgSO_4}=\dfrac{0,1.120}{52,2}.100\%\approx22,99\%\)
Đúng 1
Bình luận (0)
Cho 2,4g nhôm tác dụng với 300ml dung dịch HCl 1M (D=1,2 g/ml)
a, Chất nào còn dư, khối lượng dư là bao nhiêu
b, Tính nồng độ phần trăm dung dịch thu được sau phản ứng
Cho 2,4g Mg tác dụng với 20ml dung dịch H2SO4, sau phản ứng thu được V lít khí hidro ở đktc.Tính nồng độ mol H2SO4 đã dùng và V.
Help!!:(
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(V_{H_2SO_4}=20ml=0,02\left(l\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
0,1--->0,1----------->0,1------>0,1
\(CM=\dfrac{n}{V}=\dfrac{0,1}{0,02}=5M\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
Hòa tan 11,2g Fe và 2,4g Mg tác dụng vừa đủ với 109,5g dung dịch HCl. Tính nồng độ % của dung dịch HCl đã dùng.
Cho 2,4g kim loại A tác dụng với dung dịch HCl 7,3% vừa đủ sau khi phản ứng kết thúc thu được 2,24l H2(ở đktc).
a)Xác định kim loại A
b)Tính nồng độ % chất tan trong dung dịch mới
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(\dfrac{0.2}{n}.......................0.1\)
\(M_A=\dfrac{2.4}{\dfrac{0.2}{n}}=12n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow M=24\)
\(A:Mg\)
\(m_{MgCl_2}=0.1\cdot95=9.5\left(g\right)\)
\(m_{ddHCl}=\dfrac{0.2\cdot36.5}{7.3\%}=100\left(g\right)\)
\(m_{dd}=2.4+100-0.1\cdot2=102.2\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{9.5}{102.2}\cdot100\%=9.3\%\)
Đúng 2
Bình luận (0)
Giúp mik vớiB1: Cho 26g kẽm tác dụng vừa đủ với dung dịch H2SO4 loãng có nồng độ 20% a,Tính thể tích chất khí tạo thành (ở dktc và khối lượng muối tạo thành )b,Tính khối lượng dd H2SO4 20% cần dùng cho phản ứngc,Tính nồng độ %dd thu được sau phản ứngB2:Cho 12,8g hỗn hợp A gồm Mg và MgO vào tác dụng vừa đủ với dung dịch HCl 14,6% , thu được 4,48 lít chất khí(ở dktc)a,Tính % khối lượng mỗi chất trong A b, Tính khối lượng dung dịch HCl 14,6% dùng cho phản ứngc,Tính nồng độ % chất tan cho ...
Đọc tiếp
Giúp mik với
B1: Cho 26g kẽm tác dụng vừa đủ với dung dịch H2SO4 loãng có nồng độ 20%
a,Tính thể tích chất khí tạo thành (ở dktc và khối lượng muối tạo thành )
b,Tính khối lượng dd H2SO4 20% cần dùng cho phản ứng
c,Tính nồng độ %dd thu được sau phản ứng
B2:Cho 12,8g hỗn hợp A gồm Mg và MgO vào tác dụng vừa đủ với dung dịch HCl 14,6% , thu được 4,48 lít chất khí(ở dktc)
a,Tính % khối lượng mỗi chất trong A
b, Tính khối lượng dung dịch HCl 14,6% dùng cho phản ứng
c,Tính nồng độ % chất tan cho dung dịch sau phản ứng
Bài 1 :
PTHH : Zn + H2SO4 ------> ZnSO4 + H2
\(n_{Zn}=\frac{m}{M}=\frac{26}{65}=0,4\left(mol\right)\)
Theo PTHH : nH2 = nZn = 0,4 mol
=> Khối lượng H2 được tạo ra ở đktc là :
\(V=n\times22,4\)
\(\Rightarrow V_{H_2}=0,4\times22,4\)
\(\Rightarrow V_{H_2}=8,96\left(l\right)\)
Theo PTHH : nZnSO4 = nZn = 0,4 mol
=> Khối lượng muối được tạo thành là :
\(m=n\times M\)
\(\Rightarrow m_{ZnSO_4}=0,4\times161\)
\(\Rightarrow m_{ZnSO_4}=64,4\left(g\right)\)
b) Theo PT : \(n_{H_2SO_4}=n_{Zn}=0,4\left(mol\right)\)
=> Khối lượng \(H_2SO_4\)cần dùng cho phản ứng là :
\(m=n\times M\)
\(\Rightarrow m_{H_2SO_4}=0,4\times98\)
\(\Rightarrow m_{H_2SO_4}=39,2\left(g\right)\)
c) Nồng độ phần trăm thu được sau phản ứng là :
\(C\%=\frac{m_{ct}}{m_{dd}}\times100\%\)
\(\Rightarrow C\%=\frac{39,2}{64,4}\times100\%\approx60,9\%\)
Vậy :.........................