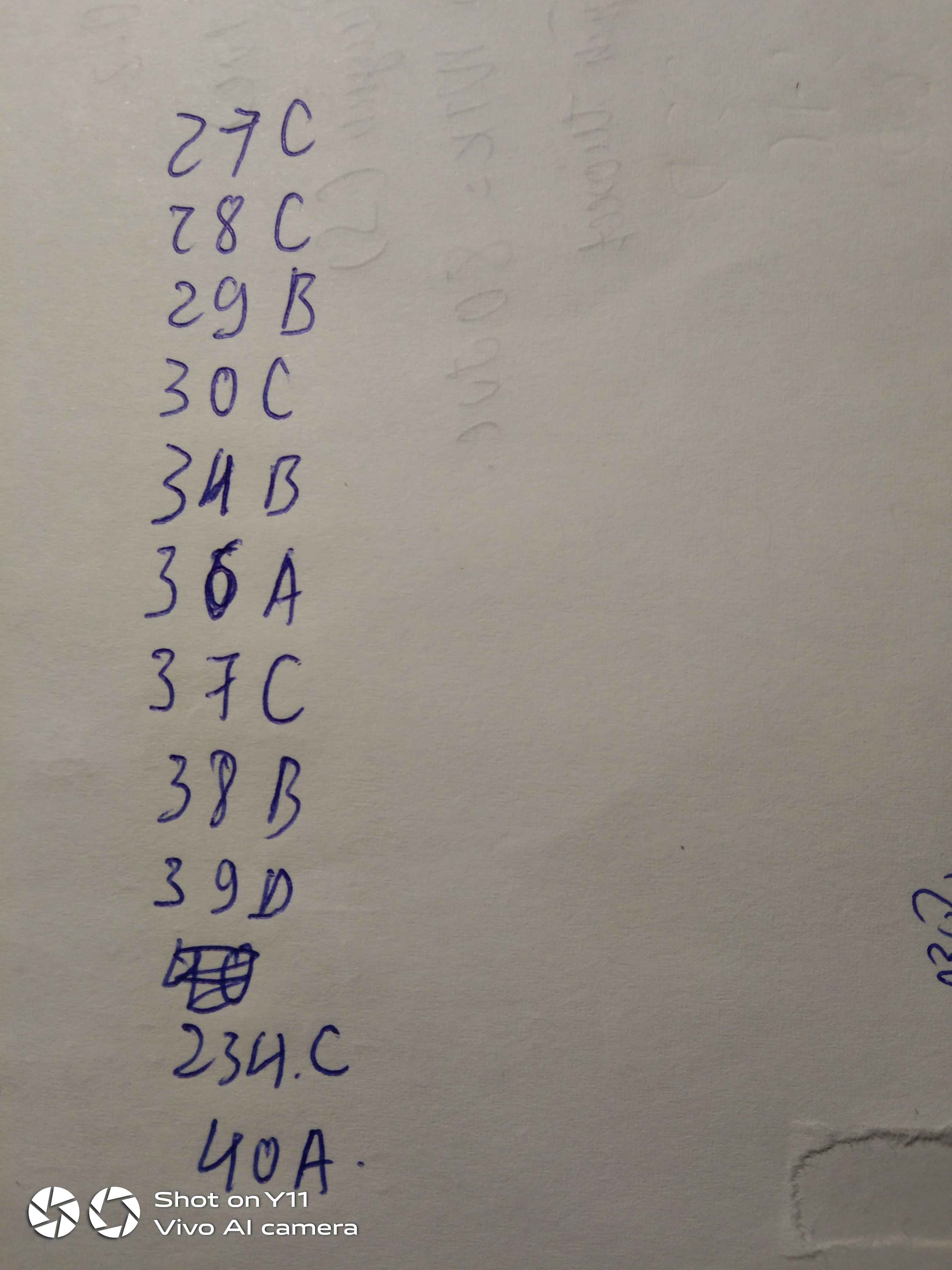Tính pH của các dung dịch sau :
a) dung dịch HNO3 0,1M
b) dung dịch Ca(OH)2 0,05M

Những câu hỏi liên quan
Tính số mol, nồng độ mol ion H+ và OH- và pH của dung dịch axit b) HNO3 0,04M c) dung dịch HCl 0.001M d) dung dịch H2SO4 0,003M e) dung dịch HNO3 có pH=2 f) dung dịch H2SO4 có pH=4 g) 200ml dung dịch H2SO4 0,01M + 100ml dung dịch HCl 0,05M Giúp em với ạ
CÂU 3.1: Tính khối lượng KOH có 500 ml dung dịch KOH có pH 12,3.CÂU 3.2: Tính khối lượng HNO3 (đktc) có trong 200 ml dung dịch có pH 2CÂU 4: Trộn 100 ml dung dịch Ba(OH)2 0,05M vào 400 ml dung dịch HNO3 0,02M thu được dung dịch X. Tính giá trị pH của dung dịch X.CÂU 5: Trộn 300ml dung dịch hỗn hợp X gồm H2SO4 0,1M và HCl 0,05M với 200ml dung dịch KOH 0,4M. Tính giá trị pH của dung dịch thu được?CÂU 6: Trộn V lít dung dịch HCl 0,05 M với 2 lít dung dịch Ba(OH)2 0,01M thu được dung dịch X có pH...
Đọc tiếp
CÂU 3.1: Tính khối lượng KOH có 500 ml dung dịch KOH có pH = 12,3.
CÂU 3.2: Tính khối lượng HNO3 (đktc) có trong 200 ml dung dịch có pH = 2
CÂU 4: Trộn 100 ml dung dịch Ba(OH)2 0,05M vào 400 ml dung dịch HNO3 0,02M thu được dung dịch X. Tính giá trị pH của dung dịch X.
CÂU 5: Trộn 300ml dung dịch hỗn hợp X gồm H2SO4 0,1M và HCl 0,05M với 200ml dung dịch KOH 0,4M. Tính giá trị pH của dung dịch thu được?
CÂU 6: Trộn V lít dung dịch HCl 0,05 M với 2 lít dung dịch Ba(OH)2 0,01M thu được dung dịch X có pH = 2. Tính giá trị của V?
Em cần hỗ trợ câu nào? Em làm được câu nào chưa?
Đúng 0
Bình luận (0)
Cho 100 ml dung dịch Ca( OH )2 1M vào 300 ml dung dịch HNO3 0,5M, sau phản ứng thu được dung dịch X
a) Tính nông độ các chất trong X
b) Cho biết dung dịch X có tính axit hay trung tính? pH của dung dịch X như thế nào?
c) Để trung hòa vừa đủ lượng axit HNO3 ban đầu người ta cần dùng bao nhiêu ml dung dịch NaOH 20% ( biết dung dịch d=1,2g/ml )
Câu 3: Tính pH của dung dịch sau. a. HNO3 0,01M b. Ca(OH)2 0,0005M
Câu 27: Nhóm các dung dịch có pH 7 là:A. HCl, NaOH B. H2SO4, HNO3 C. NaOH, Ca(OH)2 D. BaCl2, NaNO3Câu 28: Dung dịch Ca(OH)2 và dung dịch NaOH có những tính chất hóa học của bazơ tan làA. Làm đổi màu chất chỉ thị, tác dụng với oxit axitB. Làm đổi màu chất chỉ thị, tác dụng với axitC. Làm đổi màu chất chỉ thị, tác dụng với oxit axit và axitD. Tác dụng với oxit axit và axitCâu 29: Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?A. Làm đổ...
Đọc tiếp
Câu 27: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH B. H2SO4, HNO3 C. NaOH, Ca(OH)2 D. BaCl2, NaNO3
Câu 28: Dung dịch Ca(OH)2 và dung dịch NaOH có những tính chất hóa học của bazơ tan là
A. Làm đổi màu chất chỉ thị, tác dụng với oxit axit
B. Làm đổi màu chất chỉ thị, tác dụng với axit
C. Làm đổi màu chất chỉ thị, tác dụng với oxit axit và axit
D. Tác dụng với oxit axit và axit
Câu 29: Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?
A. Làm đổi màu quỳ tím và phenophtalein
B. Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
C. Tác dụng với oxit axit tạo thành muối và nước
D. Tác dụng với axit tạo thành muối và nước
Câu 30: Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3 B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2 D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Câu 34: Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl B. Nước vôi trong
C. Dung dịch HCl D. Dung dịch NaNO3
Câu 36: Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
A. Ca(OH)2 và Na2CO3. B. NaOH và Na2CO3.
C. KOH và NaNO3. D. Ca(OH)2 và NaCl
Câu 37: Cặp chất khi phản ứng với nhau tạo ra dung dịch NaOH và khí H2:
A. Na2O và H2O B. Na2O và CO2 C. Na và H2O D. NaOH và HCl
Câu 38: Cặp chất đều làm đục nước vôi trong Ca(OH)2:
A. CO2, Na2O B. CO2, SO2 C. SO2, K2O D. SO2, BaO
Câu 39: Dãy các bazơ đều làm đổi màu quỳ tím và dung dịch phenolphtalein:
A. KOH, Ca(OH)2, Cu(OH)2, Zn(OH)2 B. NaOH, Al(OH)3, Ba(OH)2, Cu(OH)2
C. Ca(OH)2, KOH, Zn(OH)2, Fe(OH)2 D. NaOH, KOH, Ca(OH)2, Ba(OH)2
Câu 234: Dung dịch NaOH và dung dịch Ca(OH)2 không phản ứng với cặp chất:
A. HCl, H2SO4 B. CO2, SO3 C. Ba(NO3)2, NaCl D. H3PO4, ZnCl2
Câu 40: Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
A. CO2, P2O5, HCl, CuCl2 B. CO2, P2O5, KOH, CuCl2
C. CO2, CaO, KOH, CuCl2 D. CO2, P2O5, HCl, KCl
27. c
28. c
29. c
34. b
36. a
37. c
38. b
39. d
234. c
40. a
Đúng 0
Bình luận (0)
Giúp mình câu này với. Tính pH của các dung dịch sau: a. Dung dịch H2so5 0,01M b. Dung dịch ca(oH)2 0,03M
a) \(\left[H^+\right]=0,01.2=0,02M\)
=> pH = 1,7
b) \(\left[OH^-\right]=0,03.2=0,06M\)
=> pOH= 1,22
=> \(pH=14-1,22=12,78\)
Đúng 2
Bình luận (0)
a) pH= -log[H+]= -log[0,01.2]=1,69
b) pH= 14 - pOH= 14 + log[OH-]= 14+ log[0,03.2]=12,78
Đúng 0
Bình luận (0)
Cho 100ml dung dịch chứa HCl 1M và HNO3 1,5M vào 400 ml dung dịch NaOH 0,5M và Ca(OH)2. Tính pH của dung
dịch sau phản ứng
dd Ca(OH)2 nồng độ bao nhiêu em nhỉ?
Đúng 0
Bình luận (2)
dd Ca(OH)2 nồng độ bao nhiêu em nhỉ?
Đúng 0
Bình luận (2)
Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ 0,05M, thu được m gam kết tủa và dung dịch (X). a/ Tính m và nồng độ các ion có trong dung dịch (X) b/ pH của dung dịch (X)
Đọc tiếp
Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ 0,05M, thu được m gam kết tủa và dung dịch (X).
a/ Tính m và nồng độ các ion có trong dung dịch (X)
b/ pH của dung dịch (X)
a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1
Đúng 2
Bình luận (0)