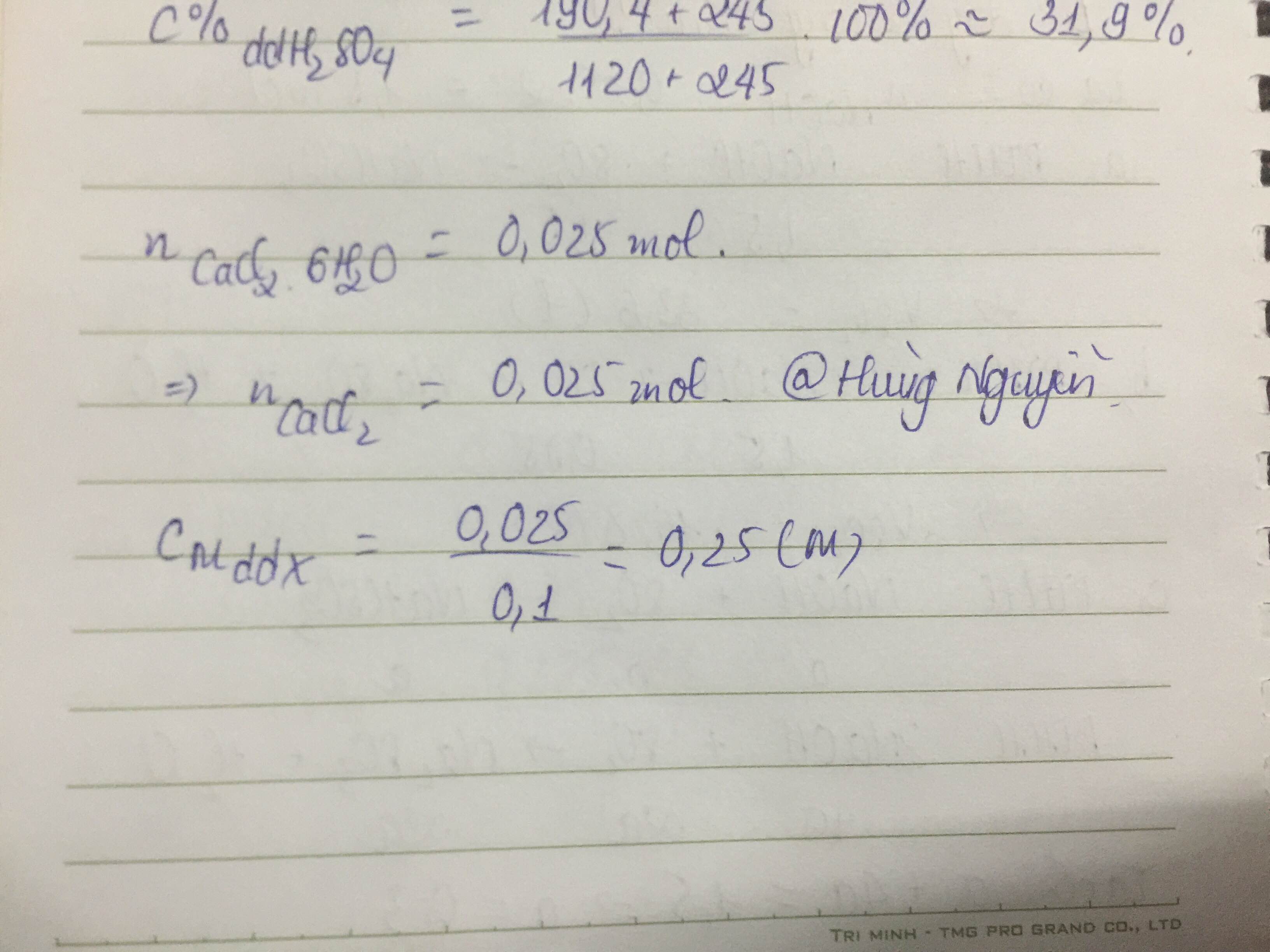Hòa tan hoàn toàn 7,45g KCl vào 558,75g dd KCl 10% thu được dd X. Tính nồng độ % của dd X

Những câu hỏi liên quan
Tính thể tich dd KCl khi hòa tan 0,15 mol KCl vào dd có nồng độ mol là 2M
\(V_{ddKCl}=\dfrac{0,15}{2}=0,075\left(l\right)\)
Đúng 4
Bình luận (0)
Câu hỏi:a) có 10 gam kcl trong 300 gam dung dịch tính nồng độ phần trăm của dung dịch kcl b) hoà tan 3mol CuSO4 vào nước thu được 1500ml dung dịch, tính nồng độ mol của dd
a) \(C\%=\dfrac{m_{KCl}}{m_{ddKCl}}.100\%=\dfrac{10}{300}.100\%\approx3,3\%\)
b) Đổi: \(1500ml=1,5l\)
\(C_{MCuSO_4}=\dfrac{n}{V}=\dfrac{3}{1,5}=2M\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 5,475g CaCl2.6H2O vào 100ml dd X. Tính nồng độ % của dd X
\(n_{CaCl_2.6H_2O}=n_{CaCl_2}=\dfrac{5,475}{219}=0,025\left(mol\right)\)
Ta có :100ml H2O ~ 100g H2O
=> \(C\%_{CaCl_2}=\dfrac{0,025.111}{100+5,4750}.100=2,63\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 5,475g CaCl2.6H2O vào 100 ml dd X. Tính nồng độ mol của dd X
Ta có : \(n_{CaCl_2.6H_2O}=n_{CaCl_2}=\dfrac{5,475}{219}=0,025\left(mol\right)\)
=> CM CaCl2= \(\dfrac{0,025}{0,1}=0,25M\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 17,6 g sắt (II) sunfua vào dd HCl dư rồi đem toàn bộ khí sinh ra vào 92,3 g nước thu được dd X.
a) Tính nồng độ % dd X
b) Cần bao nhiêu gam dd NaOH 20% phản ứng hết 1/2 dd X. Biết tạo muối trung hòa
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)\(\uparrow\)
0.2 0.2
\(H_2S+4H_2O\rightarrow H_2SO_4+4H_2\)
0.2 0.2 0.8
a. \(n_{FeS}=\dfrac{17.6}{88}=0.2mol\)
\(mdd_{H_2SO_4}=m_X=m_{H_2S}+m_{H_2O}-m_{H_2}=0.2\times34+92.3-0.8\times2=97.5g\)
\(C\%_{H_2SO_4}=\dfrac{0.2\times98\times100}{97.5}=20,1\%\)
b. \(\dfrac{1}{2}dd_X\Rightarrow n_X=0.1mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0.2 0.1
\(mdd_{NaOH}=\dfrac{0.2\times40\times100}{20}=40g\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 19,15g hỗn hợp gồm NACL và KCL vào nước để được 500 ml dd A cho 50 ml dd A tác dụng với lượng dư AGNO3 thu được 4,305 gam kết tủa. Tính CM các muối có trong dd A
PTHH bạn tự viết nha.
Từ (1) và (2)->nCl- trong 50ml dd A=nAgCl=4.305:143.5=0.03mol
->500ml dd A có 0.03x500:50=0.3 mol Cl-
đặt nNaCl=amol;nKCl=bmol
Ta có hệ: 58.5a+74.5b=19.15
a+b=0.3
->a=0.2mol;b=0.1mol
->CM NaCl=0.2:0.5=0.4M
CM KCl=0.1:0.5=0.2M
Đúng 0
Bình luận (0)
1/ Hòa tan hoàn toàn 7,8g kali vào 192,4g nước. a/ Tính thể tích khí sinh ra ở đktc b/ Tính nồng độ % của dd thu được c/ Trung hòa dd thu được bằng 100g dd HCl. Tính C% dd HCl đã dùng và C% dd muối thu được sau phản ứng
Hòa tan hoàn toàn hỗn hợp gồm 50 g CuSO4.5H2O và 27,8 gam FeSO4.7H2O vào 196,4 gam nước thu được dd A
a,Tính nồng độ mol dd A
b,Tính nồng độ phần trăm dd A
\(n_{CuSO_4}=\dfrac{50}{250}=0.2\left(mol\right)\)
\(n_{FeSO_4}=\dfrac{27.8}{278}=0.1\left(mol\right)\)
\(C_{M_{CuSO_4}}=C_{M_{FeSO_4}}=\dfrac{0.1}{0.1964}=0.5\left(M\right)\)
\(m_{dd_A}=50+27.8+196.4=274.2\left(g\right)\)
\(C\%_{CuSO_4}=\dfrac{0.1\cdot160}{274.2}\cdot100\%=6.47\%\)
\(C\%_{FeSO_4}=\dfrac{0.1\cdot152}{274.2}\cdot100\%=5.54\%\)
Đúng 2
Bình luận (1)
\(n_{CuSO_4.5H_2O}=\dfrac{50}{250}=0,2\left(mol\right)\)
=> \(m_{CuSO_4}=0,2.160=32\left(g\right)\)
\(m_{H_2O}=0,2.5.18=18\left(g\right)\)
\(n_{FeSO_4.7H_2O}=\dfrac{27,8}{278}=0,1\left(mol\right)\)=> \(m_{FeSO_4}=0,1.152=15,2\left(g\right)\)
\(m_{H_2O}=0,1.7.18=12,6\left(g\right)\)
\(m_{dd}=196,4+50+27,8=274,2\left(g\right)\)
\(V_{dd}=\dfrac{196,4+18+12,6}{1000}=0,227\left(l\right)\)
=> \(CM_{CuSO_4}=\dfrac{0,2}{0,227}=0,72M\)
\(C\%_{CuSO_4}=\dfrac{32}{274,2}.100=11,67\%\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,227}=0,44M\)
\(C\%_{CuSO_4}=\dfrac{15,2}{274,2}.100=5,54\%\)
Đúng 2
Bình luận (1)
Xem thêm câu trả lời
Bài tập 3: Hòa tan hoàn toàn 38,25 gam BaO vào HạO thu được 500ml dd X. a) Tính nồng độ mol của dung dịch X. b)Cho dd X tác dụng hết với dd H,SO, dư tính khối lượng kết tủa tạo thành. Giải: dói 500ml 0,5 lit