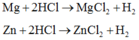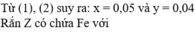cho hai thí nghiệm như sau: TN1: cho a gam sắt vào V lít (đktc) dung dịch HCl, sau khi phản ứng kết thúc đem cô cạn dung dịch thu được 6,91gam chất rắn X.
TN2: Cho hỗn hợp a gam sắt và b gam Mg vào V lít ( đktc) dung dịch HCl, sau phản ứng thu được 1,12 lít khí H2( ddktc) và cô cạn dung dịch được 7,63 gam chất rắn Y.
a.Tính a,b
b.Tính khối lượng mỗi chất con trong X,Y
( Giả sử Mg không phản ứng với nước, và trong phản ứng với axit, Mg phản ứng trước, hết Mg mới đến Fe, các phản ứng xảy ra hoàn toàn)