xác định nguyên tử mà e cuối cùng có số lượng tử thõa mãn điều kiện n + l=3 ; m+ s= +1/2

Những câu hỏi liên quan
Nguyên tố x có e cuối cùng ứng với 4 số lượng tử có tổng đại số bằng 4.5. Xác định nguyên tố X viết cấu hình e
Câu 1 : Nguyên tử của nguyên tố X có tổng số hạt là 76 , trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Xác định kí hiệu và vị trí của X trong BTH . Xác định cấu hình X2 + ; X3 + Xác định 4 số lượng e cuối cùng ; e ngoài cùng Biết Fe ( 56 ) ; Cr ( 52 ) ; Cu ( 64 )
(1)Các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử theo 1 quỹ đạo xác định tạo nên lớp vỏ nguyên tử. (2) Số electron tối đa trên lớp L là 8e (3) Nguyên tố s là nguyên tố mà nguyên tử có electron cuối cùng điền vào lớp s (4)Nếu hình dung nguyên tử như một quả cầu, thì nó có đường kính khoảng 1 angstrom Số phát biểu đúng là: A 2 B 1 C 3 D 4
23) Cho bộ bốn số lượng tử electron cuối của phân lớp ngoài cùng: n = 3, l = 2, m = -2, ms = -1/2. Hãy cho biết lớp e ngoài cùng. 24) Cho bộ 4 số lượng tử electron cuối của phân lớp ngoài cùng: n = 3, l = 2, m = +2, ms = -1/2. Nguyên tố đó là nguyên tố gì? Giúp em vs ạ
Nguyên tử của nguyên tố A tạo được hidrua có công thức ở thể khí HA (đk thường). Electron cuối cùng của nguyên tử A có tổng (n+l) =5. Viết cấu hình e của A, xác định vị trí trong bảng tuần hoàn
HA tại thể khí => thuộc nhóm VIIA => l=1
n+l =5 => n=4
Cấu hình e của A: [Ar]3d104s24p5
vị trí: Chu kì 4, nhóm VIIA trong bảng tuần hoàn.
Đúng 0
Bình luận (0)
23) Cho bộ bốn số lượng tử electron cuối của phân lớp ngoài cùng: n = 3, l = 2, m = -2, ms = -1/2. Hãy cho biết lớp e ngoài cùng. 24) Cho bộ 4 số lượng tử electron cuối của phân lớp ngoài cùng: n = 3, l = 2, m = +2, ms = -1/2. Nguyên tố đó là nguyên tố gì? Giúp em vs ạ
Hãy xác định nguyên tố X thõa điều kiện sau:a) Mỗi hợp chất do 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử nguyên tố oxi. Biết phân tử khối của hợp chất này nhẹ hơn nguyên tử khối của đồng 2 đvcb) Một đơn chất được tạo nên từ 2 nguyên tử nguyên tố X. Biết phân tử khối của hợp chất này nặng gấp 14 lần phân tử khối hidroc) Một hợp chất do 2 nguyên tử nguyên tố X liên kết với 2 nguyên tử nguyên tố hidro. Biết 2 phân tử hợp chất này nhẹ hơn phân tử canxi oxit 4 đvcd) Một hợp chất do 3 nguyên tử...
Đọc tiếp
Hãy xác định nguyên tố X thõa điều kiện sau:
a) Mỗi hợp chất do 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử nguyên tố oxi. Biết phân tử khối của hợp chất này nhẹ hơn nguyên tử khối của đồng 2 đvc
b) Một đơn chất được tạo nên từ 2 nguyên tử nguyên tố X. Biết phân tử khối của hợp chất này nặng gấp 14 lần phân tử khối hidro
c) Một hợp chất do 2 nguyên tử nguyên tố X liên kết với 2 nguyên tử nguyên tố hidro. Biết 2 phân tử hợp chất này nhẹ hơn phân tử canxi oxit 4 đvc
d) Một hợp chất do 3 nguyên tử nguyên tố X liên kết với 1 nguyên tử nguyên tố photpho và 4 nguyên tử oxi. Biết phân tử khối hợp chất này nặng bằng khối lượng phân tử axit sunfuric
e) Một hợp chất do 1 nguyên tử nguyên tố kẽm liên kết với 2 nguyên tử nguyên tố X. Biết phân tử khối hợp chất này nhẹ hơn phân tử khối của phân tử bari oxi ( 1Ba và 1o tạo nên ) 17 đvc
MÌNH ĐANG CẦN GẤP. GIẢI HỘ GIÚP MÌNH VỚI
Tách ra từng bài đi bạn ơi ! Giải hết khó nhìn lắm ạ
Đúng 0
Bình luận (1)
Nguyên tử X có tổng số hạt p, n, e là 40. Biết P ≤ N ≤ 1,5P.
a/ Xác định số p, n, e trong X. Vẽ sơ đồ cấu tạo nguyên tử. Xác định tên và ký hiệu của X.
b/ Nêu 3 ứng dụng của X mà em biết.
a)
Có: 2p + n = 40
Có \(n\ge p\)
=> 2p + n \(\ge3p\)
=> \(p\le13,33\) (1)
Có \(n\le1,5p\)
=> 2p + n \(\le3,5p\)
=> \(p\ge11,45\) (2)
(1)(2) => \(\left[{}\begin{matrix}p=12\left(Mg\right)\Rightarrow n=16\\p=13\left(Al\right)\Rightarrow n=14\end{matrix}\right.\)
- Nếu X là Mg(magie), có sơ đồ cấu tạo nguyên tử: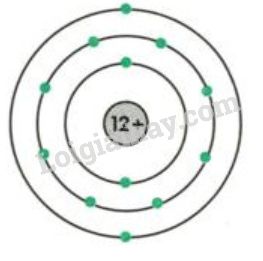
bn check lại giúp mình xem đề có thiếu dữ kiện gì không để loại trường hợp Mg nhé :) chứ 28Mg là đồng vị phóng xạ, lp 8 chẳng ai hỏi đến cái này đâu :); còn nếu bn vẫn cần thì các đồng vị phóng xạ có ứng dụng trong việc chẩn đoán, điều trị ung thư
- Nếu X là Al (Nhôm), có sơ đồ cấu tạo nguyên tử:

- Ứng dụng:
+ Chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ,...
+ Xây dựng nhà cửa, trang trí nội thất
+ Sản xuất các thiết bị gia dụng, dụng cụ nhà bếp
Đúng 1
Bình luận (0)
Cho những nguyên tố có số hiệu nguyên tử từ Z = 1 đến Z = 36. Tìm những nguyên tố có cấu hình electron thỏa mãn 2 điều kiện :
+ Lớp ngoài cùng có 8e.
+ Lớp ngoài cùng chứa số e tối đa.
Trong những nguyên tố có số hiệu nguyên tử từ Z = 1 đến Z = 36, chỉ có nguyên tố neon là có cấu hình electron thoả mãn 2 điều kiện của đề bài.
Ne : 1 s 2 2 s 2 2 p 6
Các nguyên tố khác :
He : bên ngoài chỉ có 2e.
Ar : 2/8/8 lớp ngoài cùng có 8e, nhưng lớp thứ 3 chưa đủ số e tối đa.
Kr : 2/8/18/8 lớp ngoài cùng có 8e, nhưng lớp thứ 4 chưa đủ số e tối đa.
Đúng 0
Bình luận (0)

















