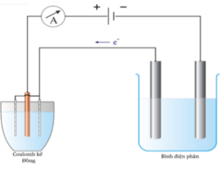
Có hai bình điện phân mắc nối tiếp. Trong bình (1) đựng 40ml dung dịch NaOH 1,73M, Trong bình (2) có chứa dung dịch gồm 0,45 mol Cu(NO3)2 và 0,4 mol HCl. Điện phân dung dịch một thời gian thì dừng lại thấy nồng độ NaOH ở bình (1) là 2M. Cho tiếp 28 gam bột Fe vào dung dịch sau điện phân ở bình (2) đến khi phản ứng hoàn toàn thu được m gam hỗn hợp 2 kim loại. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị gần nhất với m là
A. 18
B. 16
C. 17
D. 10
Đáp án C

- Sau điện phân:
+ Thể tích dung dịch NaOH ở bình 1 = 0 , 0692 2 =0,03461=34,6 ml
=> Thể tích nước bị điện phân = 40 - 34,6 = 5,4 ml
=> Số mol nước bị điện phân ở bình 1 = 5 , 4 18 = 0,3 mol
+ Bình 2:
n Cu = n H 2 O điện phân ( I ) = 0 , 3 mol ⇒ n Cu 2 + dư = 0 , 45 - 0 , 3 = 0 , 15 mol n Cl 2 = 1 2 n Cl - = 0 , 2 mol ⇒ n H 2 O điện phân ( 1 ) = 0 , 3 - 0 , 2 = 0 , 1 mol ⇒ n H + = 0 , 2 + 0 , 4 = 0 , 6 mol
- Cho 0,5 mol Fe vào dung dịch bình 2 sau phản ứng điện phân
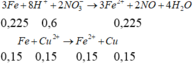
=> m = 56.(0,5-0,225-0,15)+64.0,15=16,6 gam gần với giá trị 17 nhất