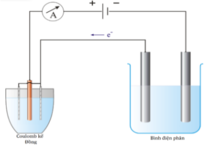
Có hai bình điện phân, trong đó bình (1) đựng 20ml dung dịch NaOH 1,73M; bình (2) đựng dung dịch gồm 0,225 mol Cu(NO3)2 và 0,2 mol HCl. Mắc nối tiếp bình (1) và bình (2). Điện phân các dung dịch bằng dòng điện một chiều với cường độ dòng điện không đổi trong một thời gian. Khi dừng điện phân, tháo ngay catot ở các bình. Sau phản ứng, thấy nồng độ NaOH ở bình (1) là 2M. Cho tiếp 14 gam bột Fe vào bình (2) đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị m là
A. 10,4
B. 9,8
C. 8,3
D. 9,4
Đáp án : C
Bình 1 : Chỉ có điện phân nước => nNaOH =const = 0,0346
=> Vdd sau = 17,3 ml => VH2O mất = 1,7 ml => mH2O = 2,7g
=> ne trao đổi = 0,15 mol . 2 = 0,3 mol = ne (bình 2)
(Vì mắc nối tiếp nên dòng điện cường độ không đổi)
Bình 2 :
Catot :
Cu2+ + 2e -> Cu
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
=> Sau phản ứng có 0,075 mol Cu2+ ; (0,2 + 0,1) mol H+ ; 0,45 mol NO3- có thể phản ứng với Fe
,nFe = 0,25 mol
3Fe + 8H+ + 2NO3- -> 3Fe2+ + 2NO + 4H2O
Fe + Cu2+ -> Fe2+ + Cu
=> Chất rắn gồm : 0,075 mol Cu và 0,0675 mol Fe
=> m = 8,3g