trung hòa 200ml dung dịch h2so4 1m bằng dung dịch naoh 1m. Tính nồng độ mol các chất có trong dung dịch thu được sau phản ứng
Giúp mik vs ạ:>>
Chương I. Các loại hợp chất vô cơ
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
PT: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
Theo PT: \(n_{Na_2SO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(n_{NaOH}=2n_{H_2SO_4}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddNaOH}=\dfrac{0,4}{1}=0,4\left(l\right)\)
\(\Rightarrow C_{M_{Na_2SO_4}}=\dfrac{0,2}{0,2+0,4}=\dfrac{1}{3}\left(M\right)\)
Đúng 2
Bình luận (0)
Nhận biết các dd ko nhãn sau:
1. Ca(OH)2, NaOH, KCl, KNO3
2. Na2SO4, NaCl, H2SO4
Hthành chuỗi PTHH sau:
Na2O → NaOH → Na2SO4 → NaCl → NaOH
↓
Na2SO3 → Na2SO4 → NaNO3
1. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: Ca(OH)2, NaOH. (1)
+ Quỳ không đổi màu: KCl, KNO3. (2)
- Cho mẫu thử nhóm (1) pư với CO2.
+ Dd thu được vẩn đục: Ca(OH)2
PT: \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: NaOH.
- Cho mẫu thử nhóm (2) pư với dd AgNO3.
+ Có tủa trắng: KCl.
PT: \(KCl+AgNO_3\rightarrow KNO_3+AgCl_{\downarrow}\)
+ Không hiện tượng: KNO3.
- Dán nhãn.
Đúng 2
Bình luận (0)
Chuỗi PT:
\(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_4\)
\(2NaCl+2H_2O\xrightarrow[_{cmn}]{^{đpdd}}2NaOH+Cl_2+H_2\)
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
\(Na_2SO_4+Ba\left(NO_3\right)_2\rightarrow2NaNO_3+BaSO_4\)
Đúng 2
Bình luận (1)
2. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: H2SO4.
+ Quỳ không đổi màu: Na2SO4, NaCl. (1)
- Cho mẫu thử nhóm (1) pư với dd BaCl2.
+ Có tủa trắng: Na2SO4.
PT: \(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_{4\downarrow}\)
+ Không hiện tượng: NaCl.
- Dán nhãn.
Đúng 1
Bình luận (0)
Cho 1,12 lít CO2 tác dụng với 100ml dung dịch NaOH vừa đủ a) Viết PTHH b) Tính nồng độ mol dung dịch NaOH C)Tính khối lượng muối sinh ra
Bài này anh có làm rồi em nha
Đúng 1
Bình luận (0)
\(n_{CO_2}=\dfrac{1,12}{22,4}=0,05mol\\ a)CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
0,05 0,1 0,05 0,05
\(b)C_{M_{NaOH}}=\dfrac{0,1}{0,1}=1M\\ c)m_{Na_2CO_3}=0,05.106=5,3g\)
Đúng 1
Bình luận (0)
phân biệt 4 lọ dd mất nhãn koh,hcl,h2so4,h20
Trích mẫu thử.
Ta có bảng sau.
| \(KOH\) | \(HCl\) | \(H_2SO_4\) | \(H_2O\) | |
| Quỳ tím | Xanh | Đỏ | Đỏ | \(-\) |
| \(BaCl_2\) | _ | _ | ↓Trắng | _ |
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Dán nhãn.
Đúng 4
Bình luận (0)
dẫn 6,72 lít khí co2 ở đktc vào 200ml dung dịch Ca(OH)2 1M. Tính khối lượng các muối sinh ra (giải bằng 2 cách)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH :
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)(1)
0,2 0,2 0,2 0,2
\(CO_2+CaCO_3+H_2O\rightarrow Ca\left(HCO_3\right)_2\)(2)
0,1 0,1 0,1 0,1
Có :
\(\dfrac{n_{CO_2}}{n_{Ca\left(OH\right)_2}}=\dfrac{0,3}{0,2}\) => Tạo cả 2 muối: CaCO3 và Ca(HCO3)2
\(m_{CaCO_3}=\left(0,2-0,1\right).100=10\left(g\right)\)
\(m_{Ca\left(HCO_3\right)_2}=0,1.162=16,2\left(g\right)\)
Đúng 1
Bình luận (0)
Dưới đây là cách giải quyết từng bài tập của bạn:
Bài 5:
a) Tính thể tích khi Hydrogen (H2) sinh ra (ở đkc):
Theo phản ứng: 2Al + 3H2SO4 -> 3H2 + 2Al2(SO4)3
Khối lượng mol của Al = 5.4 g / 27 g/mol = 0.2 mol
Khối lượng mol của H2SO4 = 150 g / (2 g/mol + 32 g/mol + 4 g/mol) = 150 g / 98 g/mol ≈ 1.53 mol
Do phản ứng có tỷ số mol của Al và H2SO4 là 2:3, vậy Al sẽ là chất dư, và số mol H2 được sinh ra sẽ bằng 2/3 số mol H2SO4.
Số mol H2 = (2/3) * 1.53 mol ≈ 1.02 mol
Thể tích H2 ở điều kiện tiêu chuẩn (0°C và 1 atm) là 24.45 L/mol.
Vậy thể tích H2 sinh ra ≈ 1.02 mol * 24.45 L/mol ≈ 24.95 L.
b) Tính nồng độ phần trăm của dung dịch H2SO4:
Khối lượng H2SO4 ban đầu = 150 g
Nồng độ phần trăm của H2SO4 = (khối lượng H2SO4 / khối lượng dung dịch) * 100%
Nồng độ phần trăm của H2SO4 = (150 g / (150 g + 5.4 g)) * 100% ≈ 96.6%
c) Tính khối lượng muối tạo thành:
Theo phản ứng: 2Al + 3H2SO4 -> 3H2 + 2Al2(SO4)3
Khối lượng mol của Al2(SO4)3 = 0.2 mol
Khối lượng muối tạo thành = (0.2 mol * 2 * (98 g/mol)) / 2 = 19.6 g.
Bài 8:
a) Tính m:
Theo phản ứng: 2Al + 6HCl -> 2AlCl3 + 3H2
Số mol H2 = 7.437 L / 22.4 L/mol = 0.332 mol
Số mol Al = 0.5 * số mol H2 = 0.5 * 0.332 mol = 0.166 mol
Khối lượng Al = 0.166 mol * 27 g/mol = 4.482 g
b) Tính nồng độ mol dung dịch HCl cần dùng:
Số mol HCl cần dùng = số mol Al = 0.166 mol
Thể tích dung dịch HCl = 300 ml = 0.3 L
Nồng độ mol của HCl = (0.166 mol / 0.3 L) ≈ 0.553 mol/L
c) Tính nồng độ mol dung dịch muối thu được:
Theo phản ứng: 2Al + 6HCl -> 2AlCl3 + 3H2
Số mol AlCl3 = 0.166 mol
Khối lượng mol của AlCl3 = 0.166 mol * (133.5 g/mol) = 22.121 g
Nồng độ mol của AlCl3 = (0.166 mol / 0.3 L) ≈ 0.553 mol/L
Lưu ý rằng phần c của câu 8 cho biết thể tích dung dịch không đáng kể thay đổi, vì vậy nồng độ mol của muối AlCl3 sau phản ứng là tương tự nồng độ mol của dung dịch HCl ban đầu.
Đúng 0
Bình luận (0)
1) Hoàn thành chuỗi PTHH: a) FeS → SO2 → SO3 → H2SO4 → Cu → CuSO4 b) Al2O3 → Al2(SO4)3 → Al(OH)3 → Al2O32) Cho 5,4g Al tan hết trong dung dịch HCl 7,3% a) Tìm khối lượng dung dịch HCl đã phản ứng. b) Tính nồng độ % dung dịch sau phản ứng. Cho Al 27, H 1, Cl 35,5(Giúp mình với ạ, TYSM)
Đọc tiếp
1) Hoàn thành chuỗi PTHH:
a) FeS → SO2 → SO3 → H2SO4 → Cu → CuSO4
b) Al2O3 → Al2(SO4)3 → Al(OH)3 → Al2O3
2) Cho 5,4g Al tan hết trong dung dịch HCl 7,3%
a) Tìm khối lượng dung dịch HCl đã phản ứng.
b) Tính nồng độ % dung dịch sau phản ứng.
Cho Al = 27, H = 1, Cl = 35,5
(Giúp mình với ạ, TYSM)
1)
a) Từ trái qua phải :
\(4FeS+7O_2\xrightarrow[]{t^o}2Fe_2O_3+4SO_2\)
\(2SO_2+O_2\xrightarrow[V_2O_5]{t^o}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(Cu+2H_2SO_{4\left(đ,n\right)}\rightarrow CuSO_4+H_2O+SO_2\uparrow\)
Bạn xem lại chỗ H2SO4 cho ra Cu nhé
b) Từ trái qua phải :
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Al_2\left(SO_4\right)_3+3NaOH\rightarrow Al\left(OH\right)_3+3Na_2SO_4\)
\(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
Đúng 2
Bình luận (4)
2) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 -->0,6--------->0,2------>0,3
a) \(m_{ddHCl}=\dfrac{\left(0,6.36,5\right)}{7,3\%}.100\%=300\left(g\right)\)
b) \(m_{ddspu}=5,4+300-0,3.2=304,8\left(g\right)\)
\(C\%_{AlCl3}=\dfrac{0,2.133,5}{304,8}.100\%=8,75\%\)
Đúng 2
Bình luận (0)

Help mình với ạ, cảm ơn.
a) Từ trái qua phải
\(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2\uparrow+H_2O\)
\(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_4\downarrow\)
b) Từ trái qua phải
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
\(Fe\left(OH\right)_2\xrightarrow[]{t^o}FeO+H_2O\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
\(2FeCl_2+4H_2SO_{4\left(đ,n\right)}\rightarrow Fe_2\left(SO_4\right)_3+4HCl+SO_2\uparrow+2H_2O\)
Đúng 3
Bình luận (2)
Bằng phương pháp hóa học hãy nhận biết các chất sau
a) Naoh ,Nacl , Na2SO4, HCL
b) KNO3, H2SO4,HCL,KOH
các bạn giúp mình nha mình đang cần gấp
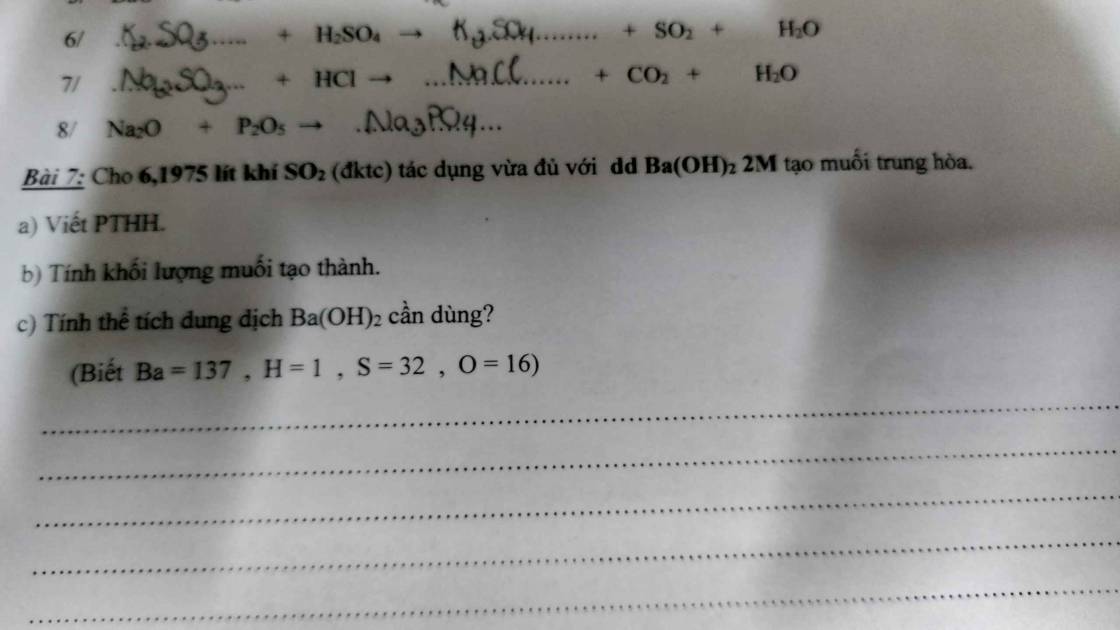


Bài 7:
a, PT: \(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_{3\downarrow}+H_2O\)
b, Ta có: \(n_{SO_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
Theo PT: \(n_{BaSO_3}=n_{SO_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{BaSO_3}=0,25.217=54,25\left(g\right)\)
c, \(n_{Ba\left(OH\right)_2}=n_{SO_2}=0,25\left(mol\right)\)
\(\Rightarrow V_{Ba\left(OH\right)_2}=\dfrac{0,25}{2}=0,125\left(l\right)\)
Đúng 3
Bình luận (0)
Bài 9:
a, A làm quỳ tím hóa xanh.
PT: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
b, \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaO}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,2}{0,05}=4\left(M\right)\)
c, \(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_{3\downarrow}+H_2O\)
Theo PT: \(n_{SO_2}=n_{Ca\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow V_{SO_2}=0,2.24,79=4,958\left(l\right)\)
d, Ruộng đất bị chua → có tính axit → Rải CaO trên ruộng, CaO gặp nước tạo Ca(OH)2 có tác dụng trung hòa axit.
Đúng 3
Bình luận (0)
Bài 8:
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
b, Ta có: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,075\left(mol\right)\Rightarrow V_{O_2}=0,075.24,79=1,85925\left(l\right)\)
c, Theo PT: \(n_{HCl}=6n_{Al_2O_3}=6.\dfrac{1}{2}n_{Al}=0,3\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,3.36,5=10,95\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{10,95}{14,6\%}=75\left(g\right)\)
Đúng 3
Bình luận (0)
Thực hiện chuỗi phản ứng sau: S + SO2 + SO3 + H2SO4 + Na2SO4 + BaSO4 Na2SO3
\(S+O_2\underrightarrow{t^o}SO_2\)
\(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(Na_2SO_4+BaCl_2\rightarrow BaSO_{4\downarrow}+2NaCl\)
Bạn xem lại đề xem từ chất nào tạo ra Na2SO3 nhé.
Đúng 3
Bình luận (0)























