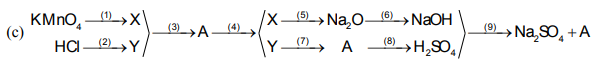Hòa tan 5,4 gam nhôm , vào dung dịch axit clohiđric: a. Tính khối lượng muối thu được b. Tính thể tích khí hiđro thoát ra (ở đktc)
Bài 38: Bài luyện tập 7
a. \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PTHH: \(n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\)
Khối lượng muối thu được:
\(m_{AlCl_3}=n_{AlCl_3}.M_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
b. Theo PTHH: \(n_{H_2}=\dfrac{n_{Al}.3}{2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
Thể tích khí hiđro thu được:
\(V_{H_2}=n_{H_2}.22,4=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 4,6 gam Na tác dụng với nước: a) Viết phương trình hóa học. b) Tính thể tích H2(ở điều kiện tiêu chuẩn) thoát ra. c)Tính khối lượng bazơ thu được.
a)\(PTHH:2Na+2H_2O\xrightarrow[]{}2NaOH+H_2\)
b)\(n_{Na}=\dfrac{4,6}{23}=0,2\left(m\right)\)
\(PTHH:2Na+2H_2O\xrightarrow[]{}2NaOH+H_2\)
tỉ lệ :2 2 2 1(mol)
số mol :0,2 0,2 0,2 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c)\(m_{NaOH}=0,2.40=8\left(g\right)\)
Đúng 1
Bình luận (1)
) HBr, H2SO3, H3PO4, H2SO4;b) Mg(OH)2, Fe(OH)3, Cu(OH)2 ;c) Ba(NO3)2, Al2(SO4)3, Na2SO3, ZnS, Na2HPO4, NaH2PO4.130PKTr.130
Đọc tiếp
) HBr, H2SO3, H3PO4, H2SO4;b) Mg(OH)2, Fe(OH)3, Cu(OH)2 ;c) Ba(NO3)2, Al2(SO4)3, Na2SO3, ZnS, Na2HPO4, NaH2PO4.130PKTr.130
đốt cháy hoàn toàn canxi cần dùng vừa đủ 11,2l không khí (biết õi chiếm 20% thể tích không khí) a) tính khối lượng canxi tham gia phản ứng b) tính khối lượng canxi oxit tạo thành
Đọc tiếp
đốt cháy hoàn toàn canxi cần dùng vừa đủ 11,2l không khí (biết õi chiếm 20% thể tích không khí) a) tính khối lượng canxi tham gia phản ứng b) tính khối lượng canxi oxit tạo thành
Để giải bài toán này, ta cần sử dụng phương pháp phản ứng hóa học của quá trình đốt cháy canxi trong không khí:
2Ca + O2 -> 2CaO
Trong đó, 2 mol canxi kết hợp với 1 mol ôxi để tạo thành 2 mol canxi oxit. Xác định khối lượng canxi cần thiết dựa trên thể tích của không khí và sử dụng tỷ lệ mol giữa canxi và canxi oxit để tính toán khối lượng canxi tạo ra và khối lượng canxi oxit tạo thành.
a) Tính toán khối lượng canxi tham gia phản ứng:
Trước tiên, tính năng không thể tích không khí cần được sử dụng để đốt cháy canxi:
Thể tích không khí = 11,2 L ôxi * (1 - 20%) = 8,96 L khí
Lưu ý rằng ôxi chiếm 20% thể tích không khí, tức là có 80% khí là các thành phần khác trong không khí (ví dụ như N2).
Tiếp theo, ta tính số mol khí cần sử dụng để phản ứng theo áp dụng định luật Avogadro:
n(O2) = V(O2)/V(mol) = 8,96/22,4 = 0,4 mol
Do phương trình phản ứng cho biết 2 mol canxi cần phản ứng với 1 mol ôxi, vậy số mol canxi cần thiết là:
n(Ca) = 0,4/2 = 0,2 mol
Khối lượng canxi cần cho phản ứng là:
m(Ca) = n(Ca) * M(Ca) = 0,2 * 40 = 8 g
Vì vậy để đốt cháy hoàn toàn 8 g canxi cần sử dụng 11,2 L không khí (biết ôxi chiếm 20% thể tích).
b) Tính toán khối lượng canxi oxit tạo thành:
Để tính khối lượng canxi oxit tạo thành, ta sử dụng tỉ lệ mol của canxi oxit và canxi trong phương trình phản ứng:
n(CaO) = n(Ca) = 0,2 mol
Khối lượng canxi oxit tạo thành là:
m(CaO) = n(CaO) * M(CaO) = 0,2 * 56 = 11,2 g
Vì vậy khối lượng canxi oxit tạo thành là 11,2 g.
Đúng 1
Bình luận (0)
Ta có: \(V_{O_2}=11,2.20\%=2,24\left(l\right)\Rightarrow n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(2Ca+O_2\underrightarrow{t^o}2CaO\)
_____0,2___0,1____0,2 (mol)
a, \(m_{Ca}=0,2.40=8\left(g\right)\)
b, \(m_{CaO}=0,2.56=11,2\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy 16,8 gam sắt trong bình chứa 6,72 lít khí oxi thu được sắt từ
a/ viết PTPỨ xảy ra và cho biết phản ứng trên thuộc loại hỏa ứng gì?
b/ chất bài còn dư sau phản ứng?
c/ tính khối lượng oxit sắt từ tạo thành?
\(a)3Fe+2O_2\rightarrow Fe_3O_4\)
\(3mol\) \(2mol\) \(1mol\)
\(0,3mol\) \(0,2mol\) \(0,1mol\)
\(b)n_{Fe}=\dfrac{m}{M}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\text{Ta thấy }O_2\text{ dư,}Fe\text{ phản ứng hết}\)
\(c)m_{Fe_3O_4}=n.M=0,1.232=23,2\left(g\right)\)
Đúng 1
Bình luận (0)
Sớm giúp e. Ạ Cho hỗn hợp A gồm SO2, O2. dA/H2=25,6.Nung A một thời gian có súc tác V2O5 Được hỗn hợp B dB/H2=32 a) tìm Hiệu suất phản ứng b)Tính %V từng khí trong A và B
Cho 30 gam hỗn hợp Ca và CaO tác dụng với nước dư thu được 6.72 lít khí H2 ở đktc. Tính khối lượng mỗi chất có trong hỗn hợp. Làm thế nào để nhận biết được dung dịch sau phản ứng là axit hay bazo.
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ pthh:Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
0,3 0,3
\(m_{Ca}=0,3.40=12\left(g\right)\\
m_{CaO}=30-12=18\left(g\right)\)
t cho Qùy tím vào dd
Qùy tím hóa đỏ là axit
Qùy tím hóa xanh là bazo
Đúng 2
Bình luận (0)
Cho kim loại kẽm phản ứng hoàn toàn với 200 gam axit sunfuric 10% a)Tính thể tích khí Hidro sinh ra ở điều kiện tiêu chuẩn. b)Tính số mol muối tạo thành .
a) \(n_{H_2SO_4}=\dfrac{200.10\%}{98}=\dfrac{10}{49}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
\(\dfrac{10}{49}\)------>\(\dfrac{10}{49}\)--->\(\dfrac{10}{49}\)
=> \(V_{H_2}=\dfrac{10}{49}.22,4=\dfrac{32}{7}\left(l\right)\)
b) \(n_{ZnSO_4}=\dfrac{10}{49}\left(mol\right)\)
Đúng 2
Bình luận (0)
Al2O3+6HCl->2AlCl3+3H2O
0,1------0,6-------0,2---------0,3
n Al2O3=0,1 mol
=>m HCl=0,6.36,5=21,9g
=>mAlCl3=0,2.133,5=26,7g
Đúng 1
Bình luận (0)
a, PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
b, Có: \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=6n_{Al_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, Theo PT: \(n_{AlCl_3}=2n_{Al_2O_3}=0,2\left(mol\right)\Rightarrow m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
\(n_{H_2}=3n_{Al_2O_3}=0,3\left(mol\right)\Rightarrow n_{H_2}=0,3.2=0,6\left(mol\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
X: là O2
Y: là H2
A: là H2O
\(\left(1\right)2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\left(2\right)Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\left(3\right)2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
\(\left(4\right)2H_2O\rightarrow\left(đp\right)2H_2+O_2\)
\(\left(5\right)4Na+O_2\rightarrow\left(t^o\right)2Na_2O\)
\(\left(6\right)Na_2O+H_2O\rightarrow2NaOH\)
\(\left(7\right)2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
\(\left(8\right)H_2O+SO_3\rightarrow H_2SO_4\)
\(\left(9\right)2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
Đúng 3
Bình luận (4)