Hợp chất hữu cơ Achứa C, H, O.Trong đó thành phần % theo khối lượng. là 64,865% C và 13,51%H.Xác định CTPT của A, biết khốilượng mol của Alà 74.
Bài 32. Luyện tập chương III : Phi kim - Sơ lược về bảng tuần hoàn nguyên tố hóa học
%O=100%-64,856%-13,51%=31,634%
%H=m\(_H\)/m\(_A\).100%
<--> m\(_H\)=%H.m\(_A\)/100=13,51.74/100=10g
-->số phân tử hiđrô là :10/1 = 10 phân tử
tương tự: m\(_C\)=64,865.74/100=48g(gần bằng)
--> số phân tử cacbon là:48/12=4 phân tử
tương tự:m\(_O\)=21,634.74/100=16g(gần bằng)
-->số phân tử O là:16/16=1 phân tử
vậy công thức phân tử của A là:\(C_4H_{10}O\)
kí tự / trong bài là thay cho dấu chia nha bn,chúc bn học tốt
Đúng 0
Bình luận (0)
Đặt CTPT của hợp chất A là CxHyOz
%m O = 100% - 64,865%-13,51% = 21,625%
Ta có : \(\dfrac{m_C}{\%m_C}=\dfrac{m_H}{\%m_H}=\dfrac{m_O}{\%m_O}=\dfrac{M_A}{100}\)
\(\Leftrightarrow\) \(\dfrac{12x}{64,865}\)= \(\dfrac{y}{13,51}\)= \(\dfrac{16z}{21,625}\) = \(\dfrac{74}{100}\)
\(\Leftrightarrow\) x = \(\dfrac{74.64,865}{12.100}\) = 4
y = \(\dfrac{74.13,51}{100}\) = 10
z = \(\dfrac{74.21,625}{16.100}\)= 1
Vậy CTPT của A là \(C_4H_{10}O\)
Đúng 1
Bình luận (0)
Đốt cháy 3g cacbon trong khí oxi thể tích khí cacbonic tạo thành là 4,2 l (đkC) tính H
Một oxit kim loại có công thức là MxOy, trong đó M chiếm 72,41% khối lượng. Khử hoàn toàn oxit này bằng khí CO thu được 16,8 gam kim loại M. Hòa tan lượng M bằng HNO3 đặc nóng thu được muối M hóa trị III và 0,9 mol khí NO2. Viết các phương trình phản ứng và xá định oxit kim loại
Đốt cháy hoàn toàn 0,2 mol một anken , toàn bộ sản phẩm cháy đc hấp thụ vào 295,2g dd NaOH 20%. Sau thí nghiệm nồng độ dd NaOH dư là 8,45%. Biết các phản ứng xảy ra hoàn toàn
1) Xđ CT phân tử của A
2) Hỗn hợp X gồm A và H2 có tỉ khối hơi so vs H2 là 6,2. Đun nóng X vs Ni xúc tác đến phản ứng hoàn toàn thu đc hỗn hợp Y
a)C/m Y k làm mất màu dd brom
b) Đốt cháy hoàn toàn Y đc 25,2g H2O. Tính V mỗi khí trong hỗn hợp X ở dktc
Đọc tiếp
Đốt cháy hoàn toàn 0,2 mol một anken , toàn bộ sản phẩm cháy đc hấp thụ vào 295,2g dd NaOH 20%. Sau thí nghiệm nồng độ dd NaOH dư là 8,45%. Biết các phản ứng xảy ra hoàn toàn
1) Xđ CT phân tử của A
2) Hỗn hợp X gồm A và H2 có tỉ khối hơi so vs H2 là 6,2. Đun nóng X vs Ni xúc tác đến phản ứng hoàn toàn thu đc hỗn hợp Y
a)C/m Y k làm mất màu dd brom
b) Đốt cháy hoàn toàn Y đc 25,2g H2O. Tính V mỗi khí trong hỗn hợp X ở dktc
.a) Gọi công thức của Anken (A) là: CnH2n (n >= 2)
PTHH: CnH2n + 3n/2 O2 - t*-> nCO2 + nH2O (1)
0,2 0,2n 0,2n
2NaOH + CO2 --> Na2CO3 + H2O (2)
0,4n 0,2n
Theo đề, mNaOH = 20.295,2/100 = 59,04 (g)
nNaOH = 59,04/40 = 1,476 (mol)
Từ (2) --> Số mol NaOH tham gia phản ứng với CO2
--> mNaOH = 0,4n.40 = 16n (gam)
Theo đề bài, ta có:
(59,04 – 16n) / (295,2 + 0,2n.44 + 0,2n.18).100 = 8,45
Giải ra ta được: n = 2
Vậy CTPT của A là C2H4
2.a) Chứng minh Y không làm mất màu dd brom:
Xét 1 mol hỗn hợp khí X (C2H4 và H2)
Ta có : M trung bình = [28x + 2.(1 – x)]/1 = 12,4
--> x = 0,4
Vậy nC2H4 = 0,4 mol
nH2 = 0,6 mol
C2H4 + H2 – N2,t*--> C2H6
Sau phản ứng (1) thì H2 còn dư --> Y (C2H6, H2 dư) không làm mất màu dd nước brom
b) Tính VC2H4 và VH2
Gọi a là số mol C2H4
b là số mol H2
C2H4 + H2 – N2,t*--> C2H6
a a a
C2H6 + 7/2 O2 –t*-> 2CO2 + 3H2O
a 3a
2H2 + O2 -t*--> 2H2O
(b –a) (b – a)
Theo đề, ta có hệ phương trình:
Mx = (28a + 2b)/(a + b) = 12,4
3a + b – a = 25,2/18 = 1,4
Giải hệ phương trình trên ta được: a = 0,4; b = 0,6
VC2H4 = 0,4.22,4 = 8,96 (lít)
VH2 = 0,6.22,4 = 13,44 (lít)
Đúng 2
Bình luận (0)
Cho hỗn hợp X gồm Ca và CaC2 vào nước dư đc hỗn hợp khí Y. Cho hỗn hợp khí Y qua bình chứa Ni nung nóng đc hỗn hợp khí Z gồm 4 chất. Cho hỗn hợp khí Z qua bình đựng dd Br2 dư rồi đốt cháy hoàn toàn hỗn hợp khí ra khỏi bình. Viết các PTHH xảy ra trong các thí nghiệm trên
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\\ CaC_2+2H_2O\rightarrow Ca\left(OH\right)_2+C_2H_2\\ C_2H_2+H_2\xrightarrow[t^o]{Ni}C_2H_4\\ C_2H_2+2H_2\xrightarrow[t^o]{Ni}C_2H_6\)
Z: C2H6, C2H4, C2H2 du, H2 du
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
hon hop con lai gom C2H6, C2H2, H2
\(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2+6H_2O\\ 2H_2+O_2\underrightarrow{t^o}2H_2O\\ 2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Bạn kiểm tra lại hộ mk nha
Đúng 0
Bình luận (3)
ai giúp hộ bài 5 của chương luyện tập III này với
a) Gọi CTHH của oxit sắt là: FexOy
PTHH: : FexOy + yCO ------> xFe + yCO2
Số mol Fe là

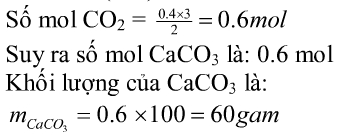
Đúng 0
Bình luận (0)
TÌM CÁC CHẤT A B C D F G Y, biet nhưng chat do la hop chjat cua cacbon, G la da voi
BT 1 : Sục từ từ V lít CO2 vào dung dịch có chứa 0,4 mol Ca(OH)2. Hãy tính khối lượng kết tủa thu được biết 10,08 \(\le\)V \(\le\)13,44.
BT 2: Hòa tan 5g CuSO4.5H2O bằng 45g dung dịch CuSO4 10% thì được dung dịch CuSO4 bão hòa ở nhiệt độ to. Tính độ tan của CuSO4 ở to.
\(2)\) \(n_{CuSO_4.5H_2O}=0,02\left(mol\right)\)\(\Rightarrow m_{CuSO_4}=0,02.160\left(g\right)\)
\(m_{CuSO_4\left(10\%\right)}=10.45\%\left(gam\right)\)
Gọi x là độ tan của CuSO4 ở \(t^o\)
| Chất tan | Dung dịch | |
| \(t^o\) | \(x\) | \(100+x\) |
| \(t^o\) | \(0,02.160+10.45\%\) | \(m_{CuSO_4.5H_2O}+m_{ddCuSO_4}=5+45\) |
\(\Rightarrow x\left(5+45\right)=\left(0,02+\dfrac{10.45\%}{160}\right)\left(100+x\right)\)
\(\Rightarrow x=18,2\left(g\right)\)
Đúng 0
Bình luận (0)
cho 13g fe và cu tác dụng với h2so4 20% thu được 1.12 l khí
a) tính % các chất tham gia phản ứng
b) tính thể tính h2so4
a) Fe +H2SO4 --> FeSO4 +H2 (1)
nH2=0,05(mol)
theo (1) : nFe=nH2=0,05(mol)
=>mFe=2,8(g)
=>mCu=10,2(g)
b) ko thể tính được thể tích H2SO4
Đúng 0
Bình luận (0)
câu b chắc bn viết thiếu đề hoặc là bn viết sai đề
Đúng 0
Bình luận (1)
Dùng 300 g quặng pirit chứa 20 phần trăm chất trơ điều chế H2SO4. Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m (g) Fe2O3. Biết tất cả phản ứng xảy ra hoàn toàn, hãy:a.Tính m H2SO4 điều chế được.b.Tính m.Giúp mik với mai mik nộp ùi
Đọc tiếp
Dùng 300 g quặng pirit chứa 20 phần trăm chất trơ điều chế H2SO4. Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m (g) Fe2O3. Biết tất cả phản ứng xảy ra hoàn toàn, hãy:
a.Tính m H2SO4 điều chế được.
b.Tính m.
Giúp mik với mai mik nộp ùi![]()






















