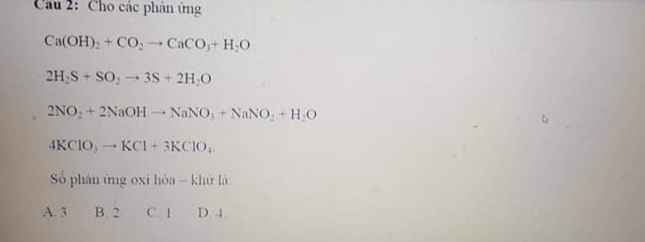Bài 10. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học.
Có P + E + N = 58
Mà P = E
=> 2P + N = 58 (1)
Vì trong hạt nhân số hạt p và n hơn kém nhau 1 đơn vị
Mà N\(\ge\)P
Nên N \(-\) P = 1 (2)
Từ (1) và (2) ta có hệ phương trình
\(\left\{{}\begin{matrix}2P+N=58\\N-P=1hay-P+N=1\end{matrix}\right.\)
=> P = 19
N = 20
P = 19 => Số hiệu nguyên tử X là 19
Đúng 0
Bình luận (0)
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là bao nhiêu?
Xem chi tiết
Ta có: P + E + N = 40
Mà P = E
=> 2P + N =40 (1)
Có tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt
=> 2P \(-\) N = 12 (2)
Từ (1) và (2) ta có hệ phương trình
\(\left\{{}\begin{matrix}2P+N=40\\2P-N=12\end{matrix}\right.\)
=> P = 13
N = 14
Số khối của X là: A = P + N = 13 +14 = 27
Đúng 1
Bình luận (0)
Liên kết công hóa trị
Biết K có điện tích hạt nhân là 19+
a. Xác định vị trí của K trong bảng tuần hoàn ? giải thích ?
b. Cho biết K có khuynh hướng nhường hay nhận e. Viết cấu hình e của ion tạo thành tương ứng từ K
a)
Cấu hình e: 1s22s22p63s23p64s1
X có 19e => X nằm ở ô thứ 19
X có 1e lớp ngoài cùng => X thuộc nhóm IA
X có 4 lớp e => X ở chu kì 4
b)
K có khuynh hướng nhường 1e để đạt đến cấu hình bền của khí hiếm, tạo thành ion K+
K --> K+ + 1e
Đúng 0
Bình luận (0)
Đáp án :A
Trừ phản ứng 1 ra thì 3 phản ứng còn lại đều là phản ứng oxi hóa khử do có sự thay đổi số oxi hóa
Đúng 0
Bình luận (0)
Ba nguyên tố A (Z = 15); D (Z = 16); E (Z = 17) có hiđroxit tương ứng là X, Y, T. Chiều tăng dần tính axit của các hiđroxit là:
A. X,Y,T
B. T,Y,X
C. Y,X,T
D. X,T,Y
Giải chi tiết giúp mình
1. Oxit cao nhất của R có công thức là RO3 , trong đó nguyên tố O chiếm 60 % về khối lượng . Xác định công thức của R , RO3 , hợp chất khí của R với H. 2.Hợp chất khí với hydro của R có công thức là RH 4 , trong đó nguyên tố H chiếm 25 % về khối lượng . Xác định công thức R , RH4 , oxit cao nhất của R 3.Trong hợp chất khí với hydro RH3 , nguyên tố R chiếm 82,35 % về khối lượng . Xác định công thức R , oxit cao nhất , hợp chất khí của R với H.
Đọc tiếp
1. Oxit cao nhất của R có công thức là RO3 , trong đó nguyên tố O chiếm 60 % về khối lượng . Xác định công thức của R , RO3 , hợp chất khí của R với H. 2.Hợp chất khí với hydro của R có công thức là RH 4 , trong đó nguyên tố H chiếm 25 % về khối lượng . Xác định công thức R , RH4 , oxit cao nhất của R 3.Trong hợp chất khí với hydro RH3 , nguyên tố R chiếm 82,35 % về khối lượng . Xác định công thức R , oxit cao nhất , hợp chất khí của R với H.
Cho 0,48 g một kim loại nhóm IIA tác dụng với dung dịch HCl dư thì thu được 0,04 g khí. Xác định tên kim loại đó.
\(n_{H_2}=\dfrac{0,04}{2}=0,02mol\)
\(R+2HCl\rightarrow RCl_2+H_2\)
0,02 0,02
Mà \(n_R=\dfrac{0,48}{M_R}=0,02\Rightarrow M_R=24\left(Mg\right)\)
Vậy kim loại đó là Magiee(Mg).
Đúng 0
Bình luận (0)