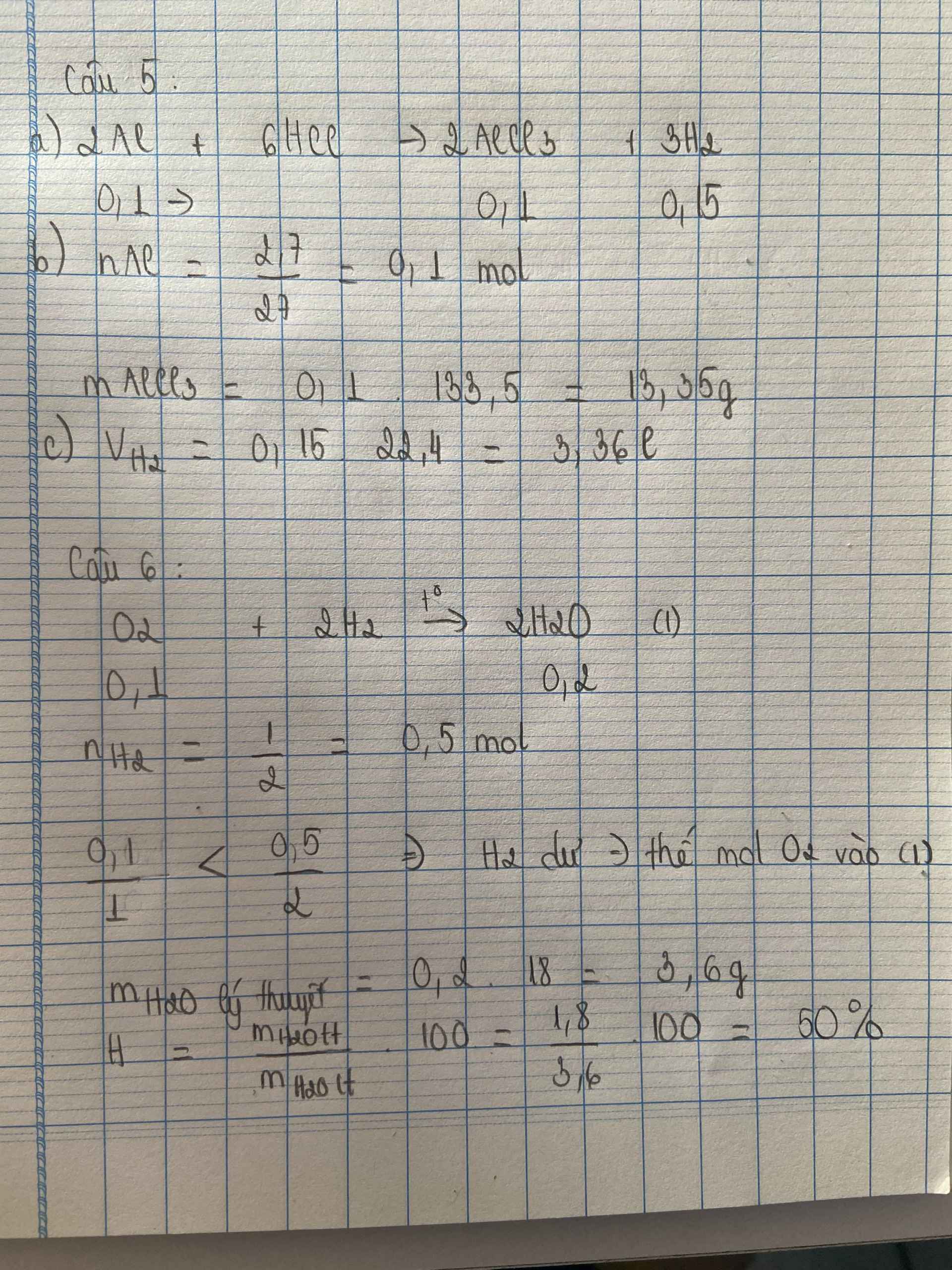lm thế nào để phân biệt chất tác dụng vs O2 và H2O v
Hóa học
Cho thử que đóm còn đang cháy:
- Cháy mãnh liệt là khí oxi
- Vụt tắt là nước
Đúng 4
Bình luận (1)
Dẫn khí hidro H2 đi qua bột đồng (II) oxit CuO nung nóng được 6,4 gam đồng và có hơi nước thoát ra.
a.Tính thể tích khí hidro ở đktc cần dùng
b.Tính khối lượng nước tạo thành
\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
pthh: \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
0,1 0,1 0,1
=>\(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\m_{H_2O}=0,1.18=1,8\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Trong phòng thí nghiệm có dung dịch H2SO4 2,5M; dung dịch KOH 2M; nước cất và các dụng cụ thí nghiệm đầy đủ. Hãy trình bày cách pha chế 400 ml dung dịch X chứa K2SO4 0,5M và KOH 0,25M?giúp mik với
Đọc tiếp
Trong phòng thí nghiệm có dung dịch H2SO4 2,5M; dung dịch KOH 2M; nước cất và các dụng cụ thí nghiệm đầy đủ. Hãy trình bày cách pha chế 400 ml dung dịch X chứa K2SO4 0,5M và KOH 0,25M?
giúp mik với![]()
![]()
![]()
\(n_{K_2SO_4}=0,4.0,5=0,2\left(mol\right)\\ n_{KOH}=0,25.0,4=0,1\left(mol\right)\)
PTHH: 2KOH + H2SO4 ---> K2SO4 + 2H2O
0,4 0,2 0,2
\(\rightarrow\left\{{}\begin{matrix}V_{KOH}=\dfrac{0,4+0,1}{2}=0,25\left(l\right)=250\left(ml\right)\\V_{H_2SO_4}=\dfrac{0,2}{2,5}=0,08\left(l\right)=80\left(ml\right)\end{matrix}\right.\\ \rightarrow V_{H_2O}=400-250-80=70\left(ml\right)\)
PP: hoà 250 ml dd KOH 2,5M vào 80 ml dd H2SO4 80 ml sau đó thêm 70 ml nước cất ta được dd ...
Đúng 3
Bình luận (1)
Hỗn hợp A gồm Mg và Zn
dung dịch B: HCl có nồng độ xM
TN1: Cho 20,2 g hhA vào 2(l) dd B thì thấy thoát ra 8,96 (l) H2 đktc
TN2: Cho 20,2 (g) hhA vào 3 l ddB thì thoát ra 11,2 l H2
a, Tìm x
b, Tìm % khối lượng mỗi chất
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Zn:y\left(mol\right)\end{matrix}\right.\Rightarrow24x+65y=20,2\left(1\right)\)
Khi tăng lượng HCl thì khí thoát ra cũng tăng.
\(\Rightarrow TN1\) chỉ còn kim loại dư.
TN2: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(BTe:2x+2y=2n_{H_2}=2\cdot0,5=1\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{0,3\cdot24}{20,2}\cdot100\%=35,64\%\)
\(\%m_{Zn}=100\%-35,64\%=64,36\%\)
Đúng 2
Bình luận (1)
Nhiệt phân hoàn toàn 20 gam canxi cacbonat (CaCO3) thu được m gam canxi oxit và V lít khí cacbon đioxit (đktc). (a) Viết phương trình hóa học xảy ra.
(b) Tính khối lượng và thể tích.
(c) Hòa tan m gam canxi oxit ở trên vào nước dư thu được bao nhiêu gam sản phẩm?
\(n_{CaCO_3}=\dfrac{20}{100}=0,2mol\)
\(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
0,2 0,2 0,2
\(m_{CaO}=0,2\cdot56=11,2g\)
\(V_{CO_2}=0,2\cdot22,4=4,48l\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
0,2 0,2
\(m_{Ca\left(OH\right)_2}=0,2\cdot74=14,8g\)
Đúng 4
Bình luận (0)
Cho 6 (g) magie phản ứng hoàn toàn với dung dịch axit sufuric
a. Viết PTHH.
b. Tính khối lượng muối thu được.
c. Nếu dùng toàn bộ lượng khí hidro ở trên đem khử với 24 (g) sắt (III) oxit ở nhiệt độ cao thì thu được bao nhiêu gam sắt?
\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\\
pthh:Mg+H_2SO_4->MgSO_4+H_2\)
0,25 0,25 0,25 0,25
\(m_{MgSO_4}=0,25.120=30\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\\
pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
LTL : \(\dfrac{0,15}{1}>\dfrac{0,25}{3}\)
=> Fe dư , H2 hết
=> \(m_{Fe}=\dfrac{1}{6}.56=\approx9,3\left(g\right)\)
Đúng 3
Bình luận (0)
Cho 13,4 gam hỗn hợp Al, CuO vào dung dịch H2SO4 10% dư thu được 6,72 lít khí H2(đktc)
a, Tính % mAl, mCuO
b, Cho 13,4 gam hỗn hợp trên tác dụng với dung dịch H2SO4 đặc nóng dư thu được dung dịch B. Tính VSO2 sản phâm khử duy nhất.
c, Tính C% các chất trong B
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,2 0,3
\(\rightarrow m_{Al}=0,2.27=5,4\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{13,4}=40,3\%\\\%m_{CuO}=100\%-40,3\%=59,7\%\end{matrix}\right.\\ n_{CuO}=\dfrac{13,4-5,4}{80}=0,1\left(mol\right)\)
PTHH:
2Al + 6H2SO4 ---> Al2(SO4)3 + 3SO2 + 6H2O
0,2 0,6 0,1 0,3
CuO + H2SO4 ---> CuSO4 + H2O
0,1 0,1 0,1
\(V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Mặc định C% H2SO4 là 98% nhé
\(m_{ddH_2SO_4}=\dfrac{98.\left(0,1+0,6\right)}{98\%}=70\left(g\right)\\ m_{dd\left(sau.pư\right)}=70-64.0,3+13,4=64,2\left(g\right)\)
\(\rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{64,2}=53,27\%\\C\%_{CuSO_4}=\dfrac{0,1.160}{64,2}=24,92\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
a)\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(m_{Al}=0,2\cdot27=5,4g\)
\(\%m_{Al}=\dfrac{5,4}{13,4}\cdot1005=40,3\%\Rightarrow\%m_{CuO}=59,7\%\)
Câu b có thiếu dữ kiện đề bài không nhỉ
Đúng 3
Bình luận (0)
1, Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
Zn + 2HCl ---> ZnCl2 + H2 (pư thế)
a 2a a a
Fe + 2HCl ---> FeCl2 + H2 (pư thế)
b 2b b b
2, Hợp chất tạo thành: ZnCl2 (kẽm clorua), FeCl2 (sắt (II) clorua) thuộc muối trung hoà
3, Theo pthh: \(n_{HCl}=2n_{H_2}=2.0,2=0,4\left(mol\right)\)
4, \(C_{M\left(HCl\right)}=\dfrac{0,4}{0,2}=2M\)
5, Hệ pt \(\left\{{}\begin{matrix}65a+56b=12,1\\a+b=0,2\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(\rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{12,1}=53,72\%\\\%m_{Fe}=100\%-53,72\%=46,28\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
1.\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow\)phản ứng thế ở hai pt trên.
2.\(Muối\):
\(ZnCl_2\): kẽm clorua
\(FeCl_2\): sắt (ll) clorua
3.\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\Rightarrow n_H=2n_{H_2}=0,4mol\)
\(\Rightarrow n_{HCl}=0,4mol\)
5.\(\left\{{}\begin{matrix}Zn:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}65x+56y=12,1\\BTe:2x+2y=2n_{H_2}=2\cdot0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\Rightarrow m_{Zn}=6,5g\\y=0,1\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{6,5}{12,1}\cdot100\%=53,72\%\)
\(\%m_{Fe}=100\%-53,72\%=46,28\%\)
Đúng 1
Bình luận (0)
Ở 20 độ C,độ tan của đường là 200g.Nếu lấy 18,8g đường hòa tan vào 10g nước ta được dung dịch bão hòa hay chưa bão hòa?
Xét \(\dfrac{18,8}{10}.100=188< 200\rightarrow\) dd chưa bh
Đúng 2
Bình luận (0)
Giúp mik câu 5,6