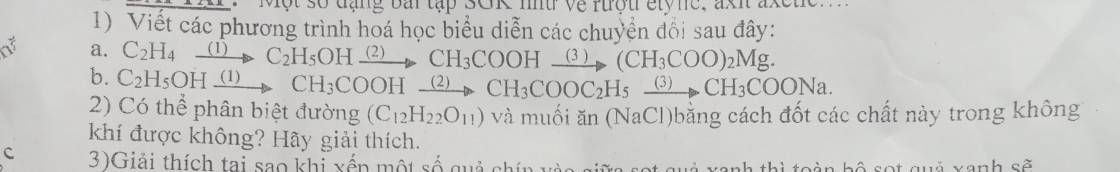Gọi tên các hợp chất có công thức hóa học sau:ALCL3,NaSO4,Ba(HCO3)2,FeS,CuSO4,KNO3,FeSO4
Hóa học
- AlCl3: Alumini clorua
- Na2SO4: Natri sunfat
- Ba(HCO3)2: Bari cacbonat
- FeS: Sắt sulfua
- CuSO4: Đồng sulfat
- KNO3: Kali nitrat
- FeSO4: Sắt sulfat
Đúng 1
Bình luận (1)
AlCl3 alumminium chloride
Na2SO4 Sodium sulfate
Ba(HCO3)2 Barium hydrogencarbonate
FeS Iron (II) sulfide
CuSO4 Copper (II) sulfate
KNO3 Potassium nitrate
FeSO4 Iron (II) sulfate
đây nhé
Đúng 1
Bình luận (0)
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch KOH 4M ở điều kiện thường a) Viết phương trình hóa học của phản ứng xảy ra. chỉ rõ chất khử chất oxi hoá b) Xác định nồng độ mol/l của những chất có trong dung dịch sau phản ứng. Biết rằng tinh thể của dung dịch sau phản ứng thay đổi không đáng kể
\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
\(MnO_2+4HCl_đ\underrightarrow{t^o}MnCl_2+2Cl_2+2H_2O\)
0,8------------------------------>1,6
Chất oxi hóa là \(MnO_2\)
\(Mn^{+4}+2e\rightarrow Mn^{+2}\)
Chất khử là HCl
\(Cl^{-1}\rightarrow Cl^0+2e\)
\(n_{KOH}=0,5.4=2\left(mol\right)\)
\(3Cl_2+2KOH\rightarrow KCl+KClO+H_2O\)
0,8--->\(\dfrac{8}{15}\)------->\(\dfrac{4}{15}\)---->\(\dfrac{4}{15}\)
\(CM_{KOH}=\dfrac{2-\dfrac{8}{15}}{0,5}=2,93M\)
\(CM_{KCl}=\dfrac{\dfrac{4}{15}}{0,5}=0,5M\\ CM_{KClO}=\dfrac{\dfrac{4}{15}}{0,5}=0,5M\)
Đúng 0
Bình luận (1)
Tại sao khi bị ong, kiến cắn người ta thường dùng vôi bôi vào vết cắn?

Vì trong kiến và côn trùng khác có chứa acid formic ( \(HCOOH\) ) và acid đó tác dụng Nước vôi (Base) => làm trung hòa acid => giảm đau, sưng , rộp
Đúng 1
Bình luận (0)
Trong nọc độc của một số côn trùng như ong, kiến có chứa một lượng acid gây bỏng da và đồng thời gây rát, ngứa. Khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt. Vôi khi tiếp xúc với acid trong nọc sẽ tạo ra phản ứng trung hoà acid – base. Phản ứng này giúp làm giảm sưng và giảm cảm giác đau, rát.
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn Fe FeO Fe2O3 và Fe3O4 trong dd HNO3 loãng nóng dư thu được 4,48l NO2 NO (dktc) và 96,8g Fe(NO3)3 . Hãy cho biết số mol HNO3 đã phản ứng và khối lượng hỗn hợp ban đầu là
14.
a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{C_2H_4Br_2}=\dfrac{9,4}{188}=0,05\left(mol\right)\)
Theo PT: \(n_{C_2H_4}=n_{C_2H_4Br_2}=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,05.22,4}{6,72}.100\%\approx16,67\%\\\%V_{CH_4}\approx83,33\%\end{matrix}\right.\)
15.
\(n_{CO_2}=\dfrac{0,66}{44}=0,015\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{0,27}{18}=0,015\left(mol\right)\Rightarrow n_H=0,015.2=0,03\left(mol\right)\)
⇒ mC + mH = 0,015.12 + 0,03.1 = 0,21 (g) < mA
→ A gồm C, H và O.
⇒ mO = 0,45 - 0,21 = 0,24 (g)
\(\Rightarrow n_O=\dfrac{0,24}{16}=0,015\left(mol\right)\)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,015:0,03:0,015 = 1:2:1
→ A có dạng (CH2O)n
Mà: MA = 30.6 = 180 (g/mol)
\(\Rightarrow n=\dfrac{180}{12+1.2+16}=6\)
→ A là C6H12O6
Đúng 1
Bình luận (0)
bài 14:
a) CH4 + Br2 ------x----->
C2H4 + Br2----------->C2H4Br2
Mol: 0,05 <---0,05 <---------- 0,05
b) nC2H4Br2 = m/M=9,4/188=0,05 (mol)
VC2H4=n . 22,4 = 1,12(mol)
VCH4= 6,72 - 1,12=5,6(mol)
%VC2H4=VC2H4 . 100/6,72 =16,7 %
%VCH4= 100%-16,7%=83,3%
Đúng 0
Bình luận (0)
Ta có: \(n_{\left(CH_3COO\right)_2Mg}=\dfrac{0,71}{142}=0,005\left(mol\right)\)
PT: \(2CH_3COOH+Mg\rightarrow\left(CH_3COO\right)_2Mg+H_2\)
__________0,01_______________0,005______0,005 (mol)
a, \(C_{M_{CH_3COOH}}=\dfrac{0,01}{0,025}=0,4\left(M\right)\)
\(V_{H_2}=0,005.22,4=0,112\left(l\right)\)
b, \(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(n_{NaOH}=n_{CH_3COOH}=0,01\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,01}{0,75}=\dfrac{1}{75}\left(l\right)=13,33\left(ml\right)\)
Đúng 1
Bình luận (0)
8.
a, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào quỳ tím.
+ Quỳ hóa đỏ: axit axetic
+ Quỳ không đổi màu: etyl axetat
- Dán nhãn.
b, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: axit axetic
+ Quỳ không đổi màu: rượu etylic
- Dán nhãn.
c, - Trích mẫu thử.
- Cho từng mẫu thử pư với Na.
+ Na tan, có hiện tượng sủi bọt khí: rượu etylic.
PT: \(Na+C_2H_5OH\rightarrow C_2H_5ONa+\dfrac{1}{2}H_2\)
+ Không hiện tượng: etyl axetat.
- Dán nhãn.
Đúng 1
Bình luận (0)
9.
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{4,5}{18}=0,25\left(mol\right)\Rightarrow n_H=0,25.2=0,5\left(mol\right)\)
Gọi CTPT của A là CxHy.
⇒ x:y = 0,2:0,5 = 2:5
→ A có dạng (C2H5)n
\(\Rightarrow n=\dfrac{58}{12.2+5}=2\)
Vậy: A là C4H10.
Đúng 1
Bình luận (0)
1.
a, (1) \(C_2H_4+H_2O\underrightarrow{^{t^o,xt}}C_2H_5OH\)
(2) \(C_2H_5OH+O_2\underrightarrow{^{mengiam,t^o}}CH_3COOH+H_2O\)
(3) \(2CH_3COOH+Mg\rightarrow\left(CH_3COO\right)_2Mg+H_2\)
b, (1) \(C_2H_5OH+O_2\underrightarrow{^{t^o,mengiam}}CH_3COOH+H_2O\)
(2) \(CH_3COOH+C_2H_5OH⇌CH_3COOC_2H_5+H_2O\) (đk: to, H2SO4 đặc)
(3) \(CH_3COOC_2H_5+NaOH\underrightarrow{t^o}CH_3COONa+C_2H_5OH\)
Đúng 0
Bình luận (0)
Cho 13 g Zn tác dụng hoàn toàn với 200ml dung dịch HCI 2,5M sau phản ứng thu được dung dịch B và khí H a. Tính thể tích khí H, thu được ở đkc b. Tính khối lượng HCI đã phản ứng? c. Tính Cụ các chất trong dung dịch B (coi thể tích dung dịch không đổi)
Tham khảo***
Để giải quyết bài toán này, chúng ta cần sử dụng các bước sau:
**a. Tính thể tích khí H, thu được ở điều kiện chuẩn (đkc):**
Đầu tiên, chúng ta cần phải xác định phản ứng hoá học giữa \( \text{Zn} \) và \( \text{HCl} \):
\[ \text{Zn} + 2\text{HCl} \rightarrow \text{ZnCl}_2 + \text{H}_2 \]
Theo phản ứng này, 1 mol \( \text{Zn} \) tương ứng với 1 mol \( \text{H}_2 \).
Vì vậy, số mol \( \text{H}_2 \) thu được là \( 13 \, \text{mol} \) (vì \( 13 \, \text{g} \) \( \text{Zn} \) đã phản ứng hoàn toàn).
Khí \( \text{H}_2 \) được thu được ở điều kiện chuẩn (đkc) có thể tích tương ứng với số mol đã tính được:
\[ V(\text{H}_2) = n(\text{H}_2) \times 22.4 \, \text{lit} \]
\[ V(\text{H}_2) = 13 \times 22.4 \, \text{lit} = 291.2 \, \text{lit} \]
Vậy, thể tích của khí \( \text{H}_2 \) thu được ở điều kiện chuẩn là \( 291.2 \, \text{lit} \).
**b. Tính khối lượng \( \text{HCl} \) đã phản ứng:**
Ta biết rằng số mol \( \text{H}_2 \) tạo ra trong phản ứng là \( 13 \, \text{mol} \).
Số mol \( \text{HCl} \) ban đầu là:
\[ n(\text{HCl}) = \frac{V(\text{HCl}) \times C(\text{HCl})}{1000} \]
\[ n(\text{HCl}) = \frac{200 \times 2.5}{1000} = 0.5 \, \text{mol} \]
Do đó, số mol \( \text{HCl} \) đã phản ứng là \( 0.5 \, \text{mol} \).
Khối lượng \( \text{HCl} \) đã phản ứng được tính bằng công thức:
\[ m(\text{HCl}) = n(\text{HCl}) \times M(\text{HCl}) \]
\[ m(\text{HCl}) = 0.5 \times 36.5 \]
\[ m(\text{HCl}) = 18.25 \, \text{g} \]
Vậy, khối lượng \( \text{HCl} \) đã phản ứng là \( 18.25 \, \text{g} \).
**c. Tính cụm các chất trong dung dịch B:**
Dung dịch B được tạo ra từ phản ứng giữa \( \text{Zn} \) và \( \text{HCl} \). Sau phản ứng, \( \text{Zn} \) sẽ tan vào dung dịch, tạo ra \( \text{ZnCl}_2 \).
Số mol \( \text{ZnCl}_2 \) được tạo ra bằng với số mol \( \text{Zn} \) đã phản ứng.
Vậy, số mol \( \text{ZnCl}_2 \) là \( 0.5 \, \text{mol} \).
Để tính cụm của các chất trong dung dịch B, ta cần biết thể tích của dung dịch.
Vì không có thông tin về thể tích dung dịch, nên không thể tính được cụm của các chất trong dung dịch B.
Đúng 0
Bình luận (0)
a, Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=0,2.2,5=0,5\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\), ta được HCl dư.
Theo PT: \(n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.24,79=4,958\left(l\right)\)
b, \(n_{HCl\left(pư\right)}=2n_{Zn}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl\left(pư\right)}=0,4.36,5=14,6\left(g\right)\)
c, \(n_{HCl\left(dư\right)}=0,5-0,4=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
\(C_{M_{ZnCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Đúng 0
Bình luận (0)
Dẫn 1,12 lít hỗn hợp gồm etilen và axetilen (đc đo ở đktc) qua dung dịch Brom. Sau khi p/ứ xảy ra hoàn toàn thấy có 12,8 gam Brom đã tham gia a) Viết phương trình p/ứ b) Tính thể tích mỗi khí trong hỗn hợp ban đầu c) Tính thể tích dung dịch brom 0,25M đã dùng ———————— giúp mik với————————